
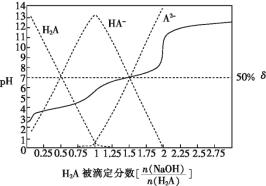
【题目】25 ℃时,用0.1 mol·L-1NaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物种分布分数δ[δ(X)=![]() ]如图所示:
]如图所示:
下列说法错误的是
A.用NaOH溶液滴定0.1 mol·L-1NaHA溶液可用酚酞作指示剂
B.0.1 mol·L-1Na2A溶液中:c(Na+)<c(HA-)+2c(A2-)
C.0.1 mol·L-1NaHA溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-)
D.H2A 的Ka2=1×10-7
【答案】BC
【解析】
由图可知,实线为0.1 mol·L-1NaOH溶液滴定二元弱酸H2A的滴定曲线,虚线为0.1 mol·L-1NaOH溶液滴定二元弱酸H2A的物种分布分数曲线。当![]() =1时,反应生成NaHA,NaHA溶液显酸性,当
=1时,反应生成NaHA,NaHA溶液显酸性,当![]() =1时,反应生成Na2A,Na2A溶液显碱性。
=1时,反应生成Na2A,Na2A溶液显碱性。
A.强碱滴定弱酸时,应选用酚酞做指示剂,则用NaOH溶液滴定0.1 mol·L-1NaHA溶液应用酚酞作指示剂,故A正确;
B. 0.1 mol·L-1Na2A溶液中存在电荷守恒关系c(Na+)+ c(H+)=c(HA-)+2c(A2-)+ c(OH—),因Na2A溶液显碱性,c(OH—) > c(H+),则:c(Na+)>c(HA-)+2c(A2-),故B错误;
C. 由图可知,当![]() =1时,反应生成NaHA,NaHA溶液显酸性,说明HA-的电离大于水解,则溶液中c(A2-)> c(H2A),故C错误;
=1时,反应生成NaHA,NaHA溶液显酸性,说明HA-的电离大于水解,则溶液中c(A2-)> c(H2A),故C错误;
D. 由图可知,当δ(X)为50%时,溶液中c(HA-)=c(A2-),pH=7,由Ka2=![]() = c(H+)=1×10-7,故D正确;
= c(H+)=1×10-7,故D正确;
故选BC。


科目:高中化学 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)= H2(g)+![]() O2(g) ΔH=242 kJ·mol-1
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+![]() O2(g)= H2O(g) ΔH=242 kJ·mol-1
O2(g)= H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可采用丙烯氨氧化法制丙烯脂,回答下列问题:
I.丙烯的制备反应方程式为C3H8(g)=C3H6(g)+H2(g)。
已知:部分共价键的键能如下:
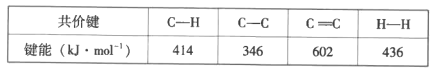
(1)制备丙烯反应的△H=__。该反应在__(“高温”或“低温”)下有利于自发进行。
(2)提高丙烯产率可以选择__(填序号)。
A.升温 B.减小压强 C.充入H2(恒容) D.加入催化剂
(3)已知:CO2(g)+H2(g)=CO(g)+H2O(g) H=-41kJ·mol-1,工业上选择向反应体系中加入CO2,提高丙烷的转化率,从化学平衡原理角度说明原因:__。
II.利用丙烯制备丙烯腈,反应方程式如下:2C3H6(g)+2NH3(g)+3O2(g)![]() 2CH2=CHCN(g)+6H2O(l) H=-1294kJ·mol-1。
2CH2=CHCN(g)+6H2O(l) H=-1294kJ·mol-1。
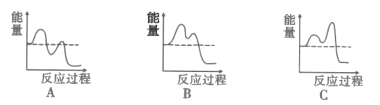
(4)主要的反应机理如下:
CH3-CH=CH2→[CH2![]() CH
CH![]() CH2]+H 慢 H>0
CH2]+H 慢 H>0
[CH2![]() CH
CH![]() CH2]+[NH]→CH2=CH-CN+3H 快
CH2]+[NH]→CH2=CH-CN+3H 快
如图能表示反应历程的是__(填序号)。.
(5)一定温度下,IL恒容密闭容器中充人等物质的量的C3H6、NH3、O2制备丙烯腈,c(C3H6)与v正随时间变化的数据如下表:
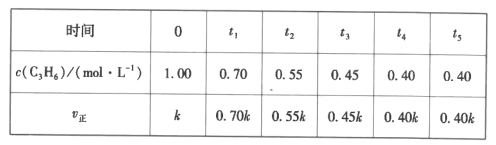
①判断t4时刻反应是否已经达到平衡状态并说明理由:__。
②列式并计算制备丙烯腈反应的平衡常数K=__(mol·L-1)-5。
③已知:正反应速率v正=kca(C3H6),根据表中数据,a=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.由13 g乙酸与2 g CO(NH2)2(尿素)形成的混合物中含有的氢原子总数为NA
B.标准状况下,体积均为2.24 L的CH4与H2O含有的电子总数均为NA
C.2 mol NO与1 mol O2在密闭容器中充分反应,产物的分子数为2NA
D.向1 L 1 mol·L-1 NaClO溶液中通入足量CO2,溶液中HClO的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工水平,常用作水果催熟剂,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示。

已知:醛可氧化生成羧酸。回答下列问题:
(1)写出下列物质的结构简式:A___;E___。
(2)写出下列反应的化学方程式,并注明反应类型:
①___、___;
②___、___;
④___、___;
(3)若想将B直接转化为D,可加入的物质为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气还原石膏的过程会发生多个反应,其中主要反应为Ⅰ、Ⅱ、Ⅲ,当CaSO4(s)与H2(g)的起始物质的量之比为1∶1时,测得平衡时物质的量如图所示。
Ⅰ:CaSO4(s)+H2(g)![]() CaO(s)+H2O(g)+SO2(g) ΔH1>0
CaO(s)+H2O(g)+SO2(g) ΔH1>0
Ⅱ:CaSO4(s)+4H2(g)![]() CaS(s)+4H2O(g) ΔH2<0
CaS(s)+4H2O(g) ΔH2<0
Ⅲ:3CaSO4(s)+CaS(s)![]() 4CaO(s)+4SO2(g) ΔH3
4CaO(s)+4SO2(g) ΔH3
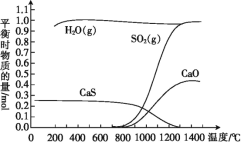
回答下列问题:
(1)100 ℃~700 ℃主要发生反应____(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(2)ΔH3=____(用含ΔH1、ΔH2的代数式表示),ΔH3____(填“>”或“<”)0,反应Ⅲ达到平衡后,升高温度,平衡____(填“正向”或“逆向”)移动。
(3)向某恒温恒容密闭容器中加入0.3 mol CaSO4和0.1 mol CaS,高温下若只发生反应Ⅲ,达到平衡时向容器中再充入少量SO2,下列说法正确的是____(填字母)。
A.重新平衡时,容器内气体总压强增大
B.重新平衡时,CaO的量减少
C.重新平衡时,SO2的浓度不变
D.CaSO4(s)、CaS(s)的质量不变
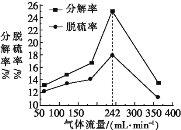
(4)其他条件一定时,H2的流量与石膏的分解率和脱硫率关系如图所示。在气体流量高于242 mL·min-1时,分解率和脱硫率均降低,可能的原因是____(只写一条)。
(5)已知其中副反应之一为2CaSO4(s)![]() 2CaO(s)+2SO2(g)+O2(g),在1625 K时,平衡常数Kp=1.45×10-5 atm3(atm表示大气压,
2CaO(s)+2SO2(g)+O2(g),在1625 K时,平衡常数Kp=1.45×10-5 atm3(atm表示大气压,![]() ≈3.81)。该温度下,反应CaO(s)+SO2(g)+
≈3.81)。该温度下,反应CaO(s)+SO2(g)+![]() O2(g)
O2(g) ![]() CaSO4(s)的K'p=____(保留整数部分)。
CaSO4(s)的K'p=____(保留整数部分)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,![]() 中所含中子数为
中所含中子数为![]()
B.![]() 溶液中含有
溶液中含有![]() 数目小于
数目小于![]()
C.熔融状态下,![]() 中所含阳离子数目为2
中所含阳离子数目为2![]()
D.25°C时,![]() 的碳酸钠溶液中,由水电离出的
的碳酸钠溶液中,由水电离出的![]() 数目为
数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工发展水平。请回答下列问题。
(1)乙烯的电子式为____,结构简式为____。
(2)鉴别甲烷和乙烯可用的试剂是____(填字母)。
A 稀硫酸 B 溴的四氯化碳溶液
C 水 D 酸性高锰酸钾溶液
(3)已知2CH3CHO+O2![]() 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如图所示。
乙烯![]() A
A![]() B
B![]() 乙酸
乙酸
反应②的化学方程式为________。
工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为____,反应类型是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备乙酸丁酯的环境温度(反应温度)是115﹣125℃,其它有关数据如下表,则以下关于实验室制备乙酸丁酯的叙述错误的是( )
物质 | 乙酸 | 1-丁醇 | 乙酸丁酯 | 98%浓硫酸 |
沸点 | 117.9℃ | 117.2℃ | 126.3℃ | 338.0℃ |
溶解性 | 溶液水和有机物 | 溶液水和有机物 | 微溶于水,溶液有机物 | 与水混合 |
A.相对价廉的乙酸与1﹣丁醇的物质的量之比应大于1:1
B.不用水浴加热是因为乙酸丁酯的沸点高于100℃
C.从反应后混合物分离出粗品的方法:用Na2CO3溶液洗涤后分液
D.由粗品制精品需要进行的一步操作:加吸水剂蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com