
【题目】丁苯酞(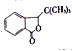 )是国际上首个作用于急性缺血性脑猝中多个病理环节的创新药物,获国家科技进步二等奖。丁苯酞的一种合成路线如下:
)是国际上首个作用于急性缺血性脑猝中多个病理环节的创新药物,获国家科技进步二等奖。丁苯酞的一种合成路线如下:
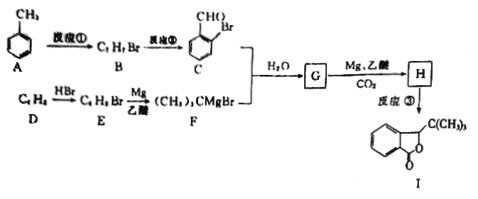
已知: 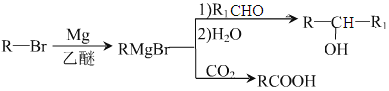
回答下列问题:
(1)H中的含氧官能团的名称是_____________,I的分子式为_______________。
(2)反应①的试剂,条件为_________________,反应②的类型是_________。
(3)G的结构简式为______________________。
(4)由D生成E的化学方程式为____________________。
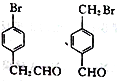
(5)芳香族化合物M(C8H7OBr)含有和C相同的官能团,其核磁共振氢谱有4组峰,且峰面积之比为2:2:2:1,写出符合条件的所有M的结构简式:_____________________。
(6)参照上述合成路线,以乙醇为原料(其他试剂任选),设计制备CH3CH2COOCH2CH3的合成路线:_____________________。
【答案】 羟基、羧基 C12H14O2 Br2、铁粉或FeBr3 氧化反应 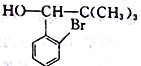
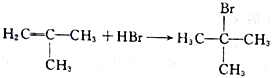
![]()
【解析】本题考查有机物的合成和推断,(1)根据信息,推出G的结构简式为: ,根据信息,推出H的结构简式为:
,根据信息,推出H的结构简式为: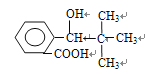 ,H中含有官能团是羟基和羧基,根据有机物成键特点,I的分子式为C12H14O2 ;
,H中含有官能团是羟基和羧基,根据有机物成键特点,I的分子式为C12H14O2 ;
(2)A与液溴,在铁作催化剂下发生取代反应,反应②是把甲基氧化成羧基,反应类型为氧化反应;(3)根据上述分析,G的结构简式为: ;(4)根据F的结构简式,推出D的结构简式为CH2=C(CH3)2,D与HBr发生加成反应,Br原子加成到氢原子最少的不饱和碳原子,即反应方程式为:
;(4)根据F的结构简式,推出D的结构简式为CH2=C(CH3)2,D与HBr发生加成反应,Br原子加成到氢原子最少的不饱和碳原子,即反应方程式为: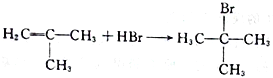 ;(5)M中含有醛基和Br原子,核磁共振氢谱有4组峰,说明有4种不同的氢原子,不同氢原子的个数为2:2:2:1,因此M的结构简式为
;(5)M中含有醛基和Br原子,核磁共振氢谱有4组峰,说明有4种不同的氢原子,不同氢原子的个数为2:2:2:1,因此M的结构简式为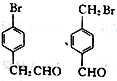 ;(6)目标物质属于酯,是由CH3CH2COOH和CH3CH2OH通过酯化反应生成,根据题干中合成路线,让乙醇与HBr发生取代反应,然后CH3CH2Br与Mg、乙醚和CO2反应生成CH3CH2COOH,因此路线为:
;(6)目标物质属于酯,是由CH3CH2COOH和CH3CH2OH通过酯化反应生成,根据题干中合成路线,让乙醇与HBr发生取代反应,然后CH3CH2Br与Mg、乙醚和CO2反应生成CH3CH2COOH,因此路线为:![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示。R与X能形成X2R、X2R2化合物,Z是地壳中含量最多的金属元素,T原子最外层电子数是K层电子数的2倍。下列推断正确的是( )

A. X和Y组成的化合物的水溶液保存在塑料瓶中 B. 原子半径和离子半径均满足:Y<Z
C. 最高价氧化物对应的水化物酸性:Z>T D. 含Z元素的盐溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机样品3.1 g完全燃烧,燃烧后的混合物通入过量的澄清石灰水,石灰水共增重 7. lg,经过滤得到10g沉淀。该有机样品可能是
A. 甲醇 B. 乙醇 C. 丙三醇 D. 甲醇和丙三醇的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA为阿伏加德罗常数)
A.124 g P4含有P—P键的个数为4NA
B.12 g石墨中含有C—C键的个数为1.5NA
C.12 g金刚石中含有C—C键的个数为4NA
D.60gSiO2中含Si—O键的个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用如图装置探究SO2和Fe(NO3)3溶液的反应原理。回答下列问题:

(1)在实验室中,欲配制250g70%的浓硫酸,需要的玻璃仪器除量筒、烧杯外,还需要有__________,装置A中盛放浓硫酸的仪器名称是___________。
(2)往三颈烧瓶中通入N2的操作在滴加浓硫酸(填“之前”或“之后”),其目的是______________。
(3)三颈烧瓶中发生反应的化学方程式为_____________________,该反应中浓硫酸表现出的性质为______________。
(4)SO2易溶于水,下列装置可用于C处虚线框内吸收尾气的是___________(填编号)。
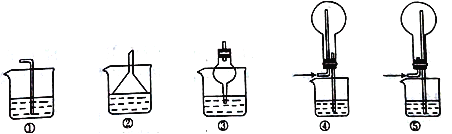
(5)装置B中产生白色沉淀的原因有两种可能。若要证明Fe3+能氧化SO2,则需要改进的地方是___________________,改进后若得到肯定结论,则装置B中发生反应的离子方程式为___________________、____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是周期表前四周期的五种元素,原子序数依次增大。X原子p轨道上有两个未成对电子;Y的气态氢化物能使石蕊试液变蓝色;Z的最外层电子数为其内层电子数的3倍;W的价电子排布式为ns(n-1)np2(n-1);R的最外层只有1个电子,次外层有18个电子。
(1)X、Y、Z、W四种元素中电负性最大的是__________(填元素符号),基态R原子的核外电子排布式为______________。
(2)X、Y、Z的最简单氢化物中,键角由大到小的顺序为_______________(用氢化物的化学式表示)。
(3)Z、W元素构成的微粒WZ42-的立体构型是________,与WZ42-互为等电子体的一种分子为____(填化学式,任写一种)。
(4)每个XY-离子中含有________个π键。
(5)已知Z、R能形成一种化合物R2Z,其晶胞结构如图所示。

①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(![]() ,
, ![]() ,
, ![]() )。则D原子的坐标参数为________,它代表_______(填元素符号)原子。
)。则D原子的坐标参数为________,它代表_______(填元素符号)原子。
②若R2Z晶体密度dg·cm-3,晶胞参数为apm,则阿伏伽德罗常数值NA=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为24。则下列判断正确的是

A. R位于元素周期表中第二周期第VA族
B. R能分别与X、Z形成共价化合物
C. 原子半径大小顺序为X > T > Y
D. Z元素的最高价氧化物对应的水化的化学式为HZO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽徳罗常数的数值,下列说法中正确的是
A. lmolNa2O和Na2O2混合物中含有的阴阳离子总数大于3NA
B. 常温常压下,20gD2O分子中所含中子数为10NA
C. 50ml12mol·L-1的盐酸与足量的MnO2共热转移的电子数为0.3 NA
D. 密闭容器中2mol NO和Imol的O2,充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇又称“木精”,是非常重要的化工原料。
(1)CO和H2在高温、高压、催化剂条件下反应可制备甲醇。根据下表中相关化学键键能(键能是断裂1mol化学键时需要吸收的能量,或形成1mol化学键时释放的能量)数据,写出CO(CO分子中含有C=O)和H2反应生成甲醇的热化学方程式______。
化学键 | H-H | O-H | C-H | C-O | C=O |
键能/KJ·mol-1 | 436 | 463 | 413 | 351 | 1076 |
(2)甲醇脱氢可制取甲醛CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。

①该脱氢反应的ΔH___0(填“>”、“<”或“=”)
②600K时,Y点甲醇的V(正)___V(逆)(填“>”、“<”或“=”),判断依据是_____
③下列叙述不能说明该脱氢反应已经达到平衡状态的是_____。
A.c(CH3OH)=c(HCHO) B.HCHO的体积分数保持不变
C.V正(CH3OH)=V逆(HCHO) D.混合气体平均分子量保持不变
(3)一定条件下,甲醇与一氧化碳反应可以合成乙酸。已知:常温下,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5;Ka(HSCN)=0.13。
常温下,将20mL0.10mol·L-1CH3COOH溶液和20mL0.10mol·L-1HSCN溶液分别与20mL0.10mol·L-1NaHCO3溶液混合,实验测得产生CO2气体体积V随时间t变化的示意图如下图所示:

①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是_______,反应结束后所得两溶液中,C(CH3COO-)____ c(SCN-)(填“>”、“<”或“=”)。
②常温条件下,将amol·L-1的CH3COOH与bmol·L-1Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为_______。
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池工作原理如图所示,则通入a气体电极的电极反应式为___________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com