
【题目】某有机物甲经氧化得到乙(C2H3O2Cl),而甲在NaOH水溶液中加热反应可得到丙,1mol丙和2mol乙反应得到一种含氯的酯(C6H8O4Cl2)。由此推断甲的结构简式为( )
A.ClCH2CH2OHB.
C.CH2ClCHOD.HOCH2CH2OH
【答案】A
【解析】
甲经氧化后得乙(分子式为C2H3O2Cl),乙应为CH2ClCOOH,说明甲中含有能被氧化的官能团,可能为-OH或-CHO,甲经水解可得丙,1mol丙和2mol乙反应的一种含氯的酯(C6H8O4Cl2),说明丙中含有两个-OH,应为CH2OHCH2OH,则甲为CH2ClCH2OH。
A.ClCH2CH2OH经氧化得ClCH2CHO,又经氧化成物质乙ClCH2COOH(分子式刚好是C2H3O2Cl),ClCH2CH2OH在NaOH水溶液中加热发生水解反应生成丙即乙二醇,乙二醇就可以和两分子乙得丙反应生成ClCH2COOCH2CH2OOCCH2Cl,A符合题意;
B.![]() 经氧化为HOCOOCH2Cl其分子式为C2H3O3Cl,B不符合题意;
经氧化为HOCOOCH2Cl其分子式为C2H3O3Cl,B不符合题意;
C.CH2ClCHO经氧化也能得到ClCH2CH2OH,但是经水解只能得到HOCH2CHO,不能与2分子乙反应,C不符合题意;
D.HOCH2CH2OH,不能发生水解反应,D不符合题意;
故选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列有关叙述正确的是( )
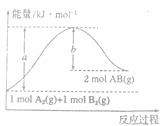
A.每生成2molAB(g)吸收bkJ热量
B.该反应中反应物的总能量高于生成物的总能量
C.反应热ΔH=+(a-b)kJ/mol
D.形成1molA-A键和1mo1B-B键,吸收akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是阿伏加德罗常数的值。下列说法正确的是
是阿伏加德罗常数的值。下列说法正确的是![]()
A.![]() 标准状况
标准状况![]() 和NO的混合物中含有的分子数为
和NO的混合物中含有的分子数为![]()
B.1mol羟基与1mol氢氧根离子含有的电子数均为![]()
C.![]() g
g![]() 完全水解形成的
完全水解形成的![]() 胶体粒子数为
胶体粒子数为![]()
D.42g乙烯和丁烯的混合物中含有的极性共价键数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的选项正确的是( )
|
|
|
|
A.配制0.10mol·L-1NaOH溶液 | B.苯萃取碘水中I2,分出水层后的操作 | C.除去CO中的CO2 | D.记录滴定终点读数为12.20mL |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质和非电解质是对化合物的一种分类方式。下列关于电解质的说法正确的是( )
A. 液态HCl不导电,所以HCl不是电解质
B. CO2溶于水形成的溶液能导电,所以CO2是电解质
C. SO2溶于水能导电,所以SO2是电解质
D. BaSO4在水溶液中难导电,但熔融状态下能导电,所以BaSO4是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是___________,其外围电子排布式为___________。
(2)已知第四电离能大小:I4(Fe)> I4 (Co),从原子结构的角度分析可能的原因是___________。
(3)配位化学创始人维尔纳发现,取1mol配合物CoCl3·6NH3(黄色)溶于水,加人足量硝酸银溶液,产生3mol白色沉淀,沉淀不溶于稀硝酸。原配合物中络离子形状为正八面体。
①根据上述事实推测原配合物中络离子化学式为___________。
②该配合物在热NaOH溶液中发生反应,并释放出气体,该反应的化学方程式___________;生成气体分子的中心原子杂化方式为___________。
(4)经X射线衍射测定发现,晶体钴在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于___________,若该堆积方式下的晶胞参数为acm,则钴原子的半径为___________pm。
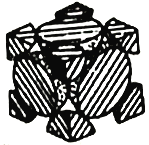
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.2.24L(标准状况下)苯在O2中完全燃烧,得到0.6NA个CO2分子
B.1mol乙酸(忽略挥发损失)与足量的C2H518OH在浓硫酸作用下加热,充分反应可生成NA个CH3CO18OC2H5分子
C.14g乙烯和丙烯混合气体中的氢原子数为2NA
D.标准状况下,11.2LCCl4中含分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为海水综合利用的流程示意图,下列说法错误的是

A.步骤①中加入除杂试剂的顺序可依次是:NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸
B.工业上常选用NaOH溶液作为沉淀剂沉淀Mg2+
C.步骤②中生成的Cl2可循环利用
D.步骤③④⑤的目的是为了富集溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com