
【题目】下列有关实验的选项正确的是( )
|
|
|
|
A.配制0.10mol·L-1NaOH溶液 | B.苯萃取碘水中I2,分出水层后的操作 | C.除去CO中的CO2 | D.记录滴定终点读数为12.20mL |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿![]() 主要成分为
主要成分为![]() 、
、![]() 、
、![]() ,少量
,少量![]() 和金属硫酸盐
和金属硫酸盐![]() 为原料,生产氧化铝并获得
为原料,生产氧化铝并获得![]() 的部分工艺流程如下:
的部分工艺流程如下:

![]() 粉碎高硫铝土矿石的目的是______。
粉碎高硫铝土矿石的目的是______。
![]() 焙烧时发生氧化还原反应:______
焙烧时发生氧化还原反应:______![]() ______
______![]() ______
______![]() ______
______![]() ,配平该方程式。
,配平该方程式。
![]() 碱浸时发生反应的化学方程式为______。
碱浸时发生反应的化学方程式为______。
![]() 过滤后向滤液中通入过量的
过滤后向滤液中通入过量的![]() 气体,反应的离子方程式为______。
气体,反应的离子方程式为______。
![]() “过滤”得到的滤渣中含有大量的
“过滤”得到的滤渣中含有大量的![]() 与
与![]() 混合后在缺氧条件下焙烧生成
混合后在缺氧条件下焙烧生成![]() 和
和![]() ,理论上完全反应消耗的
,理论上完全反应消耗的![]() :
:![]() ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列操作、现象,所得结论正确的是![]()
选项 | 操作 | 现象 | 结论 |
A | 向25mL冷水和沸水中分别滴入5滴 | 前者为黄色. 后者为红褐色 | 温度升高, 程度增大 |
B | NaOH的乙醇溶液与溴乙烷共热,产生的气体通入 酸性高锰酸钾溶液中 | 溶液褪色 | 产生的气体为乙烯 |
C | 铜铝合金加入一定量稀硝酸中,有金属剩余,再加稀硫酸 | 剩余金属质量减小 | 铝与稀硫酸反应使 剩余金属质量减小 |
D | 盛有 | 气体变为无色 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中反应![]() 是制备
是制备![]() 的一种方法,其副产物
的一种方法,其副产物![]() 是优质的镁资源。回答下列问题:
是优质的镁资源。回答下列问题:
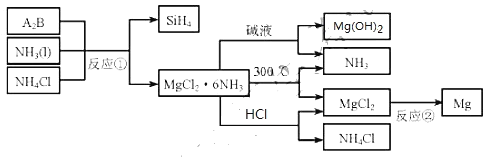
![]() 所含元素的简单离子半径由小到大的顺序
所含元素的简单离子半径由小到大的顺序![]() 除外
除外![]() :______。
:______。
Mg在元素周期表中的位置;______,![]() 的电子式:______。
的电子式:______。
![]() 的化学式为______,反应
的化学式为______,反应![]() 的必备条件是______。上图中可以循环使用的物质有______。
的必备条件是______。上图中可以循环使用的物质有______。
![]() 在一定条件下,由
在一定条件下,由![]() 和
和![]() 反应生成
反应生成![]() 和一种固体耐磨材料______
和一种固体耐磨材料______![]() 写化学式
写化学式![]() 。
。
![]() 为实现燃煤脱硫,向煤中加入浆状
为实现燃煤脱硫,向煤中加入浆状![]() ,使燃烧产生的
,使燃烧产生的![]() 转化为稳定的Mg化合物,写出该反应的化学方程式:______。
转化为稳定的Mg化合物,写出该反应的化学方程式:______。
![]() 用Mg制成的格氏试剂
用Mg制成的格氏试剂![]()
![]() 常用于有机合成,例如制备醇类化合物的合成路线如下:
常用于有机合成,例如制备醇类化合物的合成路线如下:
RBr![]() RMgBr
RMgBr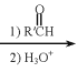
![]()
![]() :烃基;R’:烃基或
:烃基;R’:烃基或![]()
依据上述信息,写出制备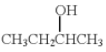 所需醛的可能结构简式:______。
所需醛的可能结构简式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述一定正确的是

A.图1所示反应:X(g)+Y(g)![]() 2Z(g),b的压强一定比a大
2Z(g),b的压强一定比a大
B.图2表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
C.图3表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量变化
D.图4表示明矾溶液受热时氢氧根浓度随温度的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可采用CO和H2合成甲醇,发生的反应为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0,若该反应在绝热、恒容的密闭容器中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是( )
CH3OH(g) ΔH<0,若该反应在绝热、恒容的密闭容器中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是( )
A.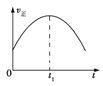
B.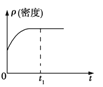
C.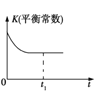
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物甲经氧化得到乙(C2H3O2Cl),而甲在NaOH水溶液中加热反应可得到丙,1mol丙和2mol乙反应得到一种含氯的酯(C6H8O4Cl2)。由此推断甲的结构简式为( )
A.ClCH2CH2OHB.
C.CH2ClCHOD.HOCH2CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧光盘金属层中含有金属Ag(其它金属微量忽略不计),从光盘中提取金属 Ag 的工艺流程如下。请回答下列问题。

(1)“氧化”阶段需在 80 ℃ 条件下进行,使用的加热方式为______________________。
(2)NaClO溶液与Ag 反应的产物为AgCl、NaOH 和O2,该反应的化学方程式为____________。有人提出用HNO3代替 NaClO氧化Ag,从反应产物的角度分析,其缺点是______________。
(3)“过滤Ⅰ”中洗涤难溶物的实验操作为_____________________________________。
(4)常用10%的氨水溶解AgCl固体, AgCl与 NH3H2O按 1:2 反应可生成 Cl-和一种阳离子_____(填阳离子的化学式)的溶液。实际反应中,即使氨水过量,“废渣”中也含有少量AgCl固体,可能的原因是__________________________________________。
(5)理论上消耗 0.1 mol N2H4H2O可“还原”得到_____ g Ag的单质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10 mL 0.50 mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
v(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.1 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:v(H2O2)≈0.033 mol/(L·min)
B.6~10 min的平均反应速率:v(H2O2)>3.3×10-2 mol/(L·min)
C.反应到6 min时,H2O2分解了40%
D.反应到10 min时,c(H2O2)≈0.24 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com