
【题目】(1)25℃时,0.05mol/L H2SO4溶液的pH= _________
(2)某温度下纯水的c(H+)=4.0×10-7mol/L,则此溶液中的c(OH-)= ________;若温度不变,滴入稀盐酸,使c(H+)=2.0×10-4mol/L,则此溶液中由水电离产生的c(H+)= _________。
(3)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) ![]() Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液使之pH> ________
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液使之pH> ________
(4)向明矾溶液中逐滴加入Ba(OH) 2溶液至硫酸根离子刚好完全沉淀时,溶液的pH________7(填>、<、=),离子反应总方程式________________________________________向明矾溶液中逐滴加入Ba(OH) 2溶液至铝离子刚好完全沉淀时,溶液的pH________7(填>、<、=),离子反应总方程式________________________________________
【答案】 1 4.0×10-7 mol/L 8.0×10-10 mol/L >5 > 略 5 略
【解析】
(1)0.05mol/LH2SO4溶液中c(H+)为0.1mol/L;
(2)依据纯水存在电离平衡,电离出的氢离子浓度和氢氧根离子浓度相同;温度不变水的离子积常数Kw不变;
(3)由Ksp=c(Cu2+)·c2(OH-)可知,如要生成Cu(OH)2沉淀,应有溶液中c(OH-)≥![]() ;
;
(4)假设明矾的物质的量为1mol,水溶液中Al3+恰好沉淀时,需氢氧根离子3mol,所以明矾与Ba(OH)2的物质的量之比为1:3,进而书写反应的离子方程式,并判断溶液的酸碱性;假设SO42-的物质的量为2mol,判断完全反应需要其它离子的物质的量,进而书写反应的离子方程式,并判断溶液的酸碱性。
(1)0.05mol/LH2SO4溶液中c(H+)为0.1mol/L,则溶液中pH=1,故答案为:1;
(2)某温度下纯水中的c(H+)=4.0×10-7mol/L,则此时溶液中的c(OH-)=4.0×10-7mol/L,水的离子积常数Kw= c(H+) c(OH-)=4.0×10-7mol/L×4.0×10-7mol/L=1.6×10-13;若温度不变,滴入稀盐酸,使c(H+)=2.0×10-4mol/L,溶液中c(OH-)=1.6×10-13/2.0×10-4mol/L=8.0×10-10 mol/L,由水电离产生的c(H+)=溶液中c(OH-)=8.0×10-10 mol/L,故答案为:4.0×10-7mol/L;8.0×10-10 mol/L;
(3)CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,由Ksp=c(Cu2+)·c2(OH-)可知,如要生成Cu(OH)2沉淀,应有溶液中c(OH-)≥![]() =
=![]() =10-9mol/L,则c(H+)≤10-5mol/L,所以pH≥-lg(10-5)=5,故答案为:5;
=10-9mol/L,则c(H+)≤10-5mol/L,所以pH≥-lg(10-5)=5,故答案为:5;
(4)假设明矾的物质的量为1mol,水溶液中含1molAl3+,明矾水溶液中Al3+恰好沉淀时,需氢氧根离子3mol,所以明矾与Ba(OH)2的物质的量之比为1:3,离子反应为2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓,此时溶液呈中性,PH=7;假设SO42-的物质的量为2mol,则明矾溶液中含有2molSO42-,1molAl3+,向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,需要2molBa(OH)2,即加入的Ba2+为2mol,OH-为4mol,生成2molBaSO4,1molAl3+与4molOH-反应生成1molAlO2-,反应的离子方程式为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,反应后溶液呈碱性,pH>7,故答案为:=;2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓;>;Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如下:
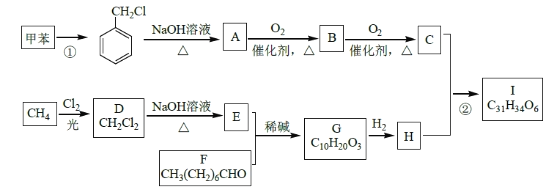

回答下列问题:
(1)反应①所需试剂、条件分别是____________;F 的化学名称为____________。
(2)②的反应类型是______________;A→B 的化学方程式为_____________________。
(3)G 的结构简式为______________;H 中所含官能团的名称是____________。
(4)化合物W的相对分子质量比化合物C大14,且满足下列条件,W的可能结构有___种。
①遇FeCl3 溶液显紫色 ②属于芳香族化合物 ③能发生银镜反应其中核磁共振氢谱显示有5 种不同化学环境的氢,峰面积比为2:2:2:1:1,写出符合要求的W 的结构简式____________。
(5)设计用甲苯和乙醛为原料制备![]() 的合成路线,其他无机试剂任选(合成路线常用的表示方式为:
的合成路线,其他无机试剂任选(合成路线常用的表示方式为:![]() )____________。
)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用题图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。

(1)仪器A的名称是______________,水通入A的进口为________。(a/b)
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为__。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择题图中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________(酚酞/甲基橙);若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积________(填序号)(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。

(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上主要利用碳热还原重晶石制得硫化钡,进而生产各种钡化合物。下图为不同反应温度下,实验中碳热还原硫酸钡反应体系的平衡组成随反应温度的变化关系。下列说法正确的是
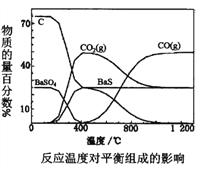
A. 约150℃,体系中开始出现BaS,说明温度越高反应速率越快
B. 400℃时发生的化学反应方程式: BaSO4+2C![]() BaS+2CO2
BaS+2CO2
C. CO—定无法还原重晶石
D. 温度高于400℃后,硫酸钡才能转化为BaS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某l00mL溶液可能含有Na+、NH4+、Fe3+、CO32 -、SO42 -、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )

A. 原溶液一定存在CO32 -和SO42 -,一定不存在Fe3+
B. 是否存在Na+只有通过焰色反应才能确定
C. 原溶液一定存在Na+,可能存在Cl-
D. 若原溶液中不存在Cl-,则c (Na+) =0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了确定黄钾铁矾[KFe3(SO4)x(OH)y]的化学式,某兴趣小组设计了如下实验:

请回答:
(1)黄钾铁矾的化学式[KFe3(SO4)x(OH)y]中x=________,y=________。
(2)写出溶液B中所含溶质的化学式________。
(3)红褐色沉淀能溶于HI溶液,并发生氧化还原反应,写出该反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素主要化合价与原子序数的关系图,下列说法不正确的是( )
A. X和W位于同一主族
B. 原子半径:Y>Z>X
C. 盐YRX与化合物WX2的漂白原理相同
D. Y和R两者的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(4分)下列应用不涉及氧化还原反应的是( )
A. Na2O2用作呼吸面具的供氧剂
B. 工业上电解熔融状态的Al2O3制备Al
C. 工业上利用合成氨实现人工固氮
D. 实验室用NH4Cl和Ca(OH)2制备NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1 mol H2O的质量为18 g/mol
B. 3.01×1023个SO2分子的质量为32 g
C. 4 g NaOH溶于1L水中,所得溶液的物质的量浓度为0.1 mol/L
D. 标准状况下,1 mol任何物质体积均为22.4 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com