
【题目】在相同条件下,等质量(金属颗粒大小相当)的下列金属与足量1 mol·L-1的盐酸反应时,速率最快的是
A. 镁 B. 铝 C. 钠 D. 铁
科目:高中化学 来源: 题型:
【题目】氮氧化物是造成雾霾天气的主要原因之一。消除氮氧化物有多种方法。
(1)可利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
则CH4(g)将NO2(g)还原为N2(g)的热化学方程式是 。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。发生的化学反应是:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g)ΔH<0。为提高氮氧化物的转化率可采取的措施是(一条即可) 。
2N2(g)+3H2O(g)ΔH<0。为提高氮氧化物的转化率可采取的措施是(一条即可) 。
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。ΔH<0
2CO2(g)+N2(g)。ΔH<0
①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。

(4)利用ClO2氧化氮氧化物反应过程如下:![]()
反应Ⅰ的化学方程式是2NO+ClO2+H2O===NO2+HNO3+2HCl,反应Ⅱ的化学方程式是。若有11.2LN2生成(标准状况),共消耗ClO2 g。
(5)工业废气中含有的NO2还可用电解法消除。用NO2为原料可制新型绿色硝化剂N2O5。制备方法之一是先将NO2转化为N2O4然后采用电解法制备N2O5,装置如下图所示。Pt甲为的电极反应式是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列利用相关数据作出的推理或判断一定正确的是
A.利用焓变数据判断反应能否自发进行
B.利用溶液的pH判断该溶液的酸碱性
C.利用平衡常数判断反应进行的程度大小
D.利用反应热数据判断反应速率的大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常见金属A、B,它们之间存在如下的转化关系(图中有些反应的产物和反应的条件没有全部标出),其中G、H为白色沉淀,C是最轻的气体。请回答下列问题:
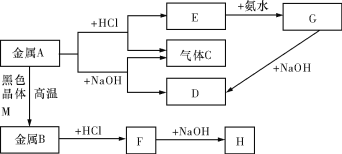
(1)写出金属A和物质D的名称或化学式:________________、________________。
(2)写出E转化为G的离子方程式:_____________________。
(3)写出H放在空气中的现象:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上“中温焙烧——钠化氧化法”回收电镀污泥中的铬已获技术上的突破。其工艺流程如下:
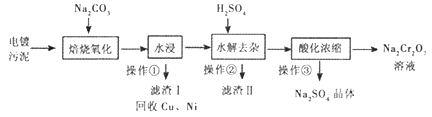
【查阅资料】
①电镀污泥中含有Cr(OH)3、Al203、ZnO、CuO、NiO等物质;水浸后溶液中含有Na2CrO4、NaAlO2、Na2ZnO2等物质;
②Na2CrO4转化成Na2Cr2O7离子反应方程式为:2 CrO42-+2H+=Cr2O72-+H2O;③Na2SO4、Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表:

请回答:
(1)操作①的名称是_______,“水浸”后的溶液呈_______性;
(2)“焙烧氧化”过程中Cr(OH)3转化成Na2CrO4的化学方程式为___________;
(3)滤渣II的主要成分有Zn(OH)2和X,生成X的离子反应方程式__________;
(4)“酸化浓缩”时,需继续加入H2SO4,然后_______、结晶、过滤。继续加入H2SO4目的是__________;
(5)以铬酸钠为原料,电化学法制备重铬酸钠的实验装置如图所示。
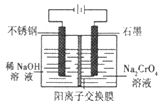
①阴极发生的电极反应式为:_____________;
②若测定阳极液中Na与Cr的物质的量之比值为d,则此时铬酸钠的转化率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)聚丙烯腈纤维商品名叫腈纶,被称为“人造羊毛”,其单体丙烯腈(C3H3N)可用“丙烯氨氧化法”生产,生成丙烯腈的热化学方程式为:C3H6(g)+NH3(g)+3/2O2(g)=C3H3N(g)+3H2O(g) △H=-515kJ/mol该法在生产中有多种副产物生成,其中丙烯醛(C3H4O)是主要副产物之一。若气态丙烯与氧气反应生成11.2g气态丙烯醛和水蒸汽,同时放出70.6kJ热量,则反应的热化学方程式为:___________,该反应在任何温度下都能自发进行,其原因是_____________。
(2)图(a)为在某一时间段一密闭体系中生成丙烯腈的反应速率与反应进程的曲线关系。由图可知,t1时刻表示体系改变的反应条件为_________;t2时刻表示体系改变另一反应条件,此时平衡______移动(填“正向”、“逆向”或“不”)。
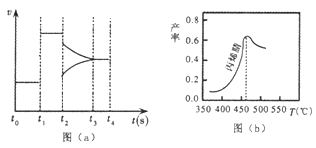
(3)图(b)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃ 。在相同的反应时间内,高于460℃时丙烯腈产率降低的可能原因是_____(填序号)。
A.催化剂活性降低 B.平衡常数变大 C.副反应增多
D.反应活化能增大 E.平衡常数变小
在相同的反应时间内.低于460℃时丙烯腈的产率______(填“是”或“不是”)对应温度下的平衡转化率,判断理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各题:
(1)粘土[主要成分Al2Si2O5(OH)4] 是制备陶瓷的原料,请以氧化物形式表示粘土的组成_____________。
(2)现用四氯化硅和氮气在氢气中加强热发生反应,可制得高纯度氮化硅,反应的化学方程式为_________________________。
(3)雕花玻璃是用氢氟酸对玻璃进行刻蚀,这一过程中发生反应的化学方程式为_______。
(4)明矾可用于净水,请说明原因________________________。
(5)下图,若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在, B是白色胶状沉淀。

①实验室中常用A与某种溶液反应制备B,请写出该反应的离子方程式 _________________。
②A与C也可以反应生成B,请写出反应的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一支50mL酸式滴定管中盛盐酸,液面恰好在amL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是( )
A.a mL B.(50﹣a)mL C.大于(50﹣a)mL D.大于a mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com