
【题目】常温下0.1mol/L NH4Cl溶液的pH最接近于( )
A.1B.5C.7D.13
科目:高中化学 来源: 题型:
【题目】利用一种微生物可将废水中苯酚的化学能直接转化为电能,装置如图所示。电池工作时,下列说法正确的是
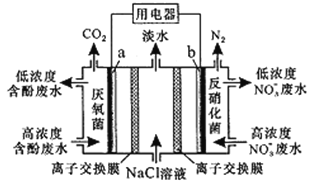
A. a为正极,发生氧化反应
B. b极上的电极反应为:2NO3-+12H+-10e-=N2↑+6H2O
C. 中间室的Cl-向左室移动
D. 左室消耗苯酚(C6H5OH)9.4g时,用电器流过2.4mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol![]()
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,下列各组热化学方程式中,Q2>Q1的是(双选)( )
A. 2H2(g)+O2(g)===2H2O(g) ΔH=-Q1
2H2(g)+O2(g)===2H2O(l) ΔH=-Q2
B. S(g)+O2(g)===SO2(g) ΔH=-Q1
S(s)+O2(g)===SO2(g) ΔH=-Q2
C. C(s)+1/2O2(g)===CO(g) ΔH=-Q1
C(s)+O2(g)===CO2(g) ΔH=-Q2
D. H2(g)+Cl2(g)===2HCl(g) ΔH=-Q1
1/2H2(g)+1/2Cl2(g)===HCl(g) ΔH=-Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质排放到空气中,会造成空气污染的是
①公共场所因抽烟产生的气体; ②燃放烟花爆竹产生的烟尘;③化工厂排放的废气;④石油燃烧产生的气体;⑤动植物呼吸排出的气体。
A. ①②③④ B. 只有①③⑤
C. 只有①③④ D. 只有①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列事实:①A+B2+=A2++B;②D+2H2O=D(OH)2+H2↑;③以B、E为电极与E的盐溶液组成原电池,电极反应为E2++2e-=E,B-2e-=B2+。由此可知A2+、B2+、D2+、E2+的氧化性强弱关系是( )。
A.D2+>A2+>B2+>E2+
B.A2+>B2+>D2+>E2+
C.D2+>E2+>A2+>B2+
D.E2+>B2+>A2+>D2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:

已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为2Na2SiO3+2NaAlO2+2H2O=Na2A12Si2O8↓+4NaOH。请回答下列问题:
(1)铝土矿中Al2O3与氢氧化钠溶液反应的离子方程式为_________________________________。
(2)在工艺流程中“酸化”时,加入的最佳物质B是________,理由是_______________________,写出酸化过程发生反应的化学方程式:________________________________。
(3)工业上用Al2O3与C、Cl2在高温条件下反应制取AlCl3,理论上每消耗6.0 g碳单质,转移1 mol电子,则反应的化学方程式为__________________________________。
(4)某同学推测铝与氧化铁发生铝热反应得到的熔融物中还含有Fe2O3,设计了如下方案来验证:取一块该熔融物投入少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3。
则物质甲是_________(填化学式),请判断该同学设计的实验方案的合理性_________(填“合理”或“不合理”)。原因是_______________________________________(若合理,则不用填写)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com