
【题目】咖啡酸具有止血功效,存在于多种中药中,其结构简式如图: ,下列说法不正确的是
,下列说法不正确的是
A. 咖啡酸可以发生取代、加成、氧化、酯化、加聚反应
B. 1mol咖啡酸最多能与4molH2反应
C. 咖啡酸分子中所有原子可能共面
D. 蜂胶的分子式为C17H16O4,在一定条件下可水解生成咖啡酸和一种一元醇A,则醇A的分子式为C8H12O
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)具有较强的还原性,还能与中强酸反应,在精细化工领域应用广泛。将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3·5H2O(大苏打)。
已知:Na2S、Na2CO3、Na2SO3、NaHCO3溶液呈碱性;NaHSO3溶液呈酸性。
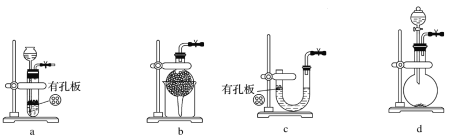
(1)实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是________(填字母代号)。
(2)向Na2S和Na2CO3的混合溶液中不断通入SO2气体的过程中,发现:
①浅黄色沉淀先逐渐增多,反应的化学方程式为_____________________________________;
②当浅黄色沉淀不再增多时,反应体系中有无色无味的气体产生,反应的化学方程式为________________________________;
③浅黄色沉淀逐渐减少(这时有Na2S2O3生成);
④继续通入过量的SO2,浅黄色沉淀又会逐渐增多,反应的化学方程式为________________________。
(3)制备Na2S2O3时,为了使反应物利用率最大化,Na2S和Na2CO3的物质的量之比应为____________;通过反应顺序,可比较出:温度相同时,同物质的量浓度的Na2S溶液和Na2CO3溶液pH更大的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下正戊烷(CH3CH2CH2CH2CH3)易发生两种裂解反应:
I.CH3CH2CH2CH2CH3(g)![]() CH3CH=CH2(g)+CH3CH3(g) △H1=+274.2kJ/mol;
CH3CH=CH2(g)+CH3CH3(g) △H1=+274.2kJ/mol;
II.CH3CH2CH2CH2CH3(g)![]() CH3CH2CH3(g)+CH2=CH2(g) △H2=+122.7kJ/mol。
CH3CH2CH3(g)+CH2=CH2(g) △H2=+122.7kJ/mol。
(1)维持体系温度T不变,总压强p恒定时,体积为V1L的正戊烷发生裂解反应,一段时间平衡后气体体积变为V2L,此时正戊烷的转化率α(正戊烷)=_______;维持体系温度不变,向体系中充入一定量的水蒸气(水蒸气在该条件下不参与反应),再次平衡后正戊烷的转化率将______(填“增大”“减小”或“不变”),原因为_____________。
(2)一定温度下,向体积为2L的密闭容器中充入0.2molCH3CH=CH2和0.5molCH3CH3发生反应CH3CH=CH2(g)+CH3CH3(g)![]() CH3CH2CH3(g)+CH2=CH2(g) △H3;5min后达到平衡状态,容器内剩余CH3CH=CH2的物质的量为0.1mol。
CH3CH2CH3(g)+CH2=CH2(g) △H3;5min后达到平衡状态,容器内剩余CH3CH=CH2的物质的量为0.1mol。
①△H3=________。
②5min内,该反应的平均反应速率v(CH3CH3)=________。
③保持温度不变,起始时向该密闭容器中充入等物质的量的CH3CH=CH2和CH3CH3,平衡后容器内CH3CH3的体积分数为______(保留一位小数)。
(3)将0.1molCH3CH3完全燃烧后的气体通入100mL一定浓度的NaOH溶液中,并将所得溶液稀释至1L。最终所得溶液中CO32-、HCO3-、H2CO3三者所占物质的量分数随原NaOH溶液浓度变化的关系如图所示:
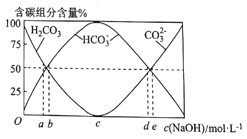
其中图中表示原氢氧化钠浓度为3mol.L-1的是_____(填“a”“b”“c”“d”或“e”)。
(4)以氢氧化钠溶液为电解质溶液,CH3CH3燃料电池的负极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年新学期初,市教育局在全市中小学开展了“节约用水用电,倡导绿色简约生活”的活动。下列做法不应该提倡的是
A.路远的同学可乘公交车上学B.作业不要使用修正带或涂改液
C.将化学实验室的废水直接排入水池D.养成随手关水关灯的习惯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B属于短周期中不同主族的元素,A、B原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若A元素的原子序数为a,则B元素的原子序数可能为( )
①a-4 ②a-5 ③a+3 ④a+4
A. ①④ B. ②③ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向100mL 0.2mol·L-1的氨水中逐滴加入0.2mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数![]() 与加入盐酸的体积V的关系如图所示,下列说法错误的是
与加入盐酸的体积V的关系如图所示,下列说法错误的是

A. 表示NH3·H2O物质的量分数变化的曲线是A
B. NH3·H2O的电离常数为10-4.74 mol·L-1
C. 当加入盐酸体积为50ml时,溶液中c(NH4+)-c(NH3·H2O)=2×(10-5-10-9)mol·L-1
D. pH=9.26时的溶液中,NH4+的水解程度等于NH3·H2O的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍及其化合物在合金材料及催化剂等方面应用广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺流程:

已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是______________________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为___________________,“浸渣”的成分除Fe2O3,FeO(OH)外还含有______________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnC12将Fe3+还原为Fe2+,所需SnC12的物质的量不少于Fe3+物质的量的_____倍;除去过量的SnC12后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,滴定时反应的离子方程式为____________。
(4)“浸出液”中c(Ca2+)=1.0×10-3mol,当除钙率达到99%时,除钙后的溶液中c(F-)=____mol·L-1[已知Ksp(CaF2)=4.0×10-11]。
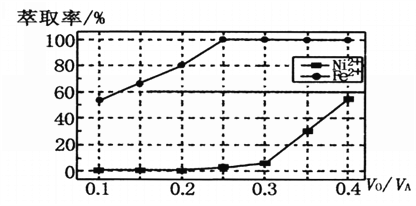
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
元素 | 结构或性质信息 |
X | 原子的L层上s电子数等于p电子数 |
Y | 原子核外的L层有3个未成对电子 |
Z | 地壳中含量最多的元素 |
Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
R | 核电荷数是Y与Q的核电荷数之和 |
E | N能层上只有一个电子,K、L、M层均排满电子 |
请根据信息回答有关问题:
(1)写出元素Y的原子核外价电子排布图: . X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为 .
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号) .
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式) , 原因是 .
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式: .
(5)R的一种配合物的化学式为RCl36H2O.已知0.01mol RCl36H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是 .
A.[R(H2O)6]Cl3
B.[R(H2O)5Cl]Cl2H2O
C.[R(H2O)4Cl2]Cl2H2O
D.[R(H2O)3Cl3]3H2O
(6)向含少量ESO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,反应的离子方程式为: , 继续滴加氨水至过量,沉淀溶解, 得到天蓝色溶液,写反应的离子方程式为: .
(7)元素E的单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示. 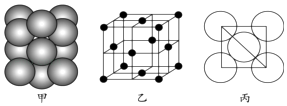
若已知该元素的原子半径为d cm,相对原子质量为M,NA代表阿伏加德罗常数,则该晶体的密度为gcm﹣3(用字母表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质] ![]()
磷酸铁锂电池对环境无污染,为绿色环保型电池,是铅酸电池的替代品,该电池的总反应为:
Li1-x FePO4+LixC6= LiFePO4+C6
(1)基态Fe2+的核外电子排布式为___________,与Fe同周期的元素中,与铜原子最外层电子数相等的元素还有___________(填元素符号),磷酸铁锂电池总反应中涉及到的C、O元素,第一电离能较大的是____________________。
(2)PO43-的空间构型是____________________。
(3)与PCl5互为等电子体的一种分子的化学式为_________。
(4)二乙烯三胺五乙酸铁-钠络合物结构如图所示,其中C原子的杂化方式为_______________。

![]()
(5)亚铁氰化钾经氯气或电解氧化,可得铁氰化钾K3Fe(CN)6],为红棕色晶体,也称赤血盐,1mol该物质含有的π键的数目为_____________。
(6)已知:LiF晶体与 NaCl晶体结构相同,F半径为0.133nm,Li+的半径为0.076nm,阴阳离子相接触,则一个晶胞中离子的空间占有率为_______ (列式并计算),分析说明该计算结果小于74.05%的原因_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com