
【题目】“变废为宝”是化工的重要主题。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有CuCl2,FeCl2等)制备碱式碳酸铜Cu2(OH)2CO3],其制备过程如下图所示:
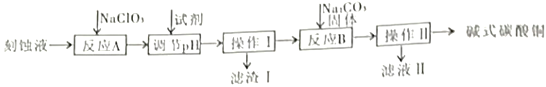
查阅资料得知,一定浓度的Cu2+、Fe2+、Fe3+生成氢氧化物沉淀的pH如下表:
金属离子 | Cu2+ | Fe2+ | Fe3+ |
开始沉淀的pH | 4.2 | 6.5 | 1.4 |
沉淀完全的pH | 6.7 | 9.7 | 3.7 |
(1)电子工业中用FeCl3溶液制作铜制印刷电路板,该反应的离子方程式为___________。
(2)操作I、操作Ⅱ所用的玻璃仪器除烧杯外还需要______________________。
(3)氯酸钠的作用是____________________________________________;反应A中氧化剂与还原剂物质的量之比是___________。
(4)调节pH的范围为___________,可以选择的试剂是___________(填序号)。
A.氨水 B.硫酸铜 C.氧化铜 D.氢氧化铜
(5)已知滤液Ⅱ中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:___________。
(6)若废液中CuCl2的含量为13.5%,则1吨废液理论上可提炼碱式碳酸铜________吨。
【答案】2Fe3++Cu=2Fe2++Cu2+ 漏斗、玻璃棒 将Fe2+氧化为Fe3+ 1:6 3.7~4.2 CD 2Cu2++3CO32-+2H2O=Cu2(OH)2CO3↓+2HCO3- 0.111
【解析】
刻蚀废液加入NaClO3把Fe2+氧化为Fe3+,调节pH除掉铁离子,滤渣为Fe(OH)3,向CuCl2溶液中加入碳酸钠固体,过滤得到碱式碳酸铜。
(1)FeCl3溶液与铜发生氧化还原反应;
(2)操作Ⅰ、操作Ⅱ是过滤,分析过滤装置所需仪器;
(3)氯酸钠把Fe2+氧化为Fe3+,根据得失电子数相等计算氧化剂与还原剂物质的量之比;
(4)根据除杂的同时不要引进新的杂质,保证铁离子沉淀完全,铜离子不沉淀选择pH;
(5)根据题意铜离子和碳酸根离子反应生成碱式碳酸铜和碳酸氢根离子书写离子方程式;
(6)利用铜的守恒,列关系式进行计算。
(1)FeCl3溶液与铜发生反应生成亚铁离子与铜离子:2Fe3++Cu=2Fe2++Cu2+;
正确答案:2Fe3++Cu=2Fe2++Cu2+
(2)操作Ⅰ、操作Ⅱ是过滤,过滤装置所需的玻璃仪器有烧杯、漏斗、玻璃棒;
正确答案:漏斗、玻璃棒
(3)氯酸钠把Fe2+氧化为Fe3+, NaClO3被还原为氯化钠,氯元素由正五价降到负一价,Fe2+到Fe3+升高一价,根据得失电子数相等,得出关系式NaClO3~6 Fe2+,即氧化剂与还原剂物质的量之比为1:6;
正确答案: 1:6
(4)调节pH使得铁离子沉淀完全,铁离子沉淀完全pH为3.7,铜离子开始沉淀pH为4.2,故应控制pH为3.7~4.2,使铁离子沉淀完全而铜离子不沉淀;氨水会引入杂质离子,硫酸铜不能使溶液pH升高,氢氧化铜和氧化铜能和氢离子反应,能调节pH,且不会引入杂质,可用作调节pH的试剂。
正确答案:3.7~4.2 CD。
(5)根据题意铜离子和碳酸根离子反应生成碱式碳酸铜和碳酸氢根离子,离子方程式为2Cu2++3CO32-+2H2O=Cu2(OH)2CO3↓+2HCO3-;
正确答案:2Cu2++3CO32-+2H2O=Cu2(OH)2CO3↓+2HCO3-
(6)设生成的碱式碳酸铜的质量为x,利用铜的守恒,列关系式进行计算
2CuCl2~Cu2(OH)2CO3
2×135吨 222吨
1吨×13.5% x
x=![]() =0.111吨
=0.111吨
正确答案:0.111


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 0.2 mol·L-1的NaCl液中含Na+的数目为0.2NA
B. 标准状况下,11.2L水中含有的水分子数目为0.5NA
C. S2和S8的混合物共6.4g,所含硫原子数一定为0.2NA
D. 将100mL0.1mol·L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶体粒子的数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某制糖厂以甘蔗为原料制糖,同时得到大量甘蔗渣,对甘蔗渣进行综合利用,可以提高经济效益,减少对环境的污染。如图所示为用甘蔗渣为原料制取各物质的转化过程图。
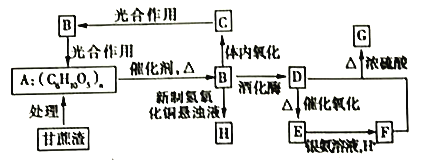
已知:①B在人体组织中发生缓慢氧化,放出热量,提供生命活动需要的能量。
②G是具有果香气味的液体,体积分数75%的D的水溶液常用于医疗消毒,并且可以代替汽油作汽车燃料。
③R—CHO![]() R—COOH
R—COOH
(1)A的化学名称为___________,B的分子式为___________。
(2)E的结构简式为___________,F分子中含有的官能团的名称为___________。
(3)D+F→G的化学方程式为___________,该反应的反应类型为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。工业级NaN3的制备分两步进行,反应的化学方程式如下:
i. 2Na +2NH3![]() 2NaNH2+ H2 ii. NaNH2+ N2O
2NaNH2+ H2 ii. NaNH2+ N2O![]() NaN3+H2O
NaN3+H2O
实验室利用如下装置模拟工业级NaN3的制备。
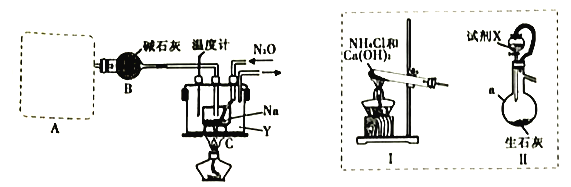
(1)装置A用于制取NH3,右图装置I和Ⅱ为气体发生装置。若选用装置I,则发生反应的化学方程式为_________________________________;若选用装置Ⅱ,则试剂X是___________(填试剂名称),仪器a的名称是___________。
(2)装置B的作用是_______________________________________________________。
(3)加热前需要先往装置C中通一段时间NH3的目的是______________________________。
(4)当观察到装置C中熔融钠单质的银白色光泽全部消失时,停止通氨气,开始通入N2O。装置C中的Y为___________(填字母)。
A.冷水浴 B.热水浴 C油浴
(5)该实验装置的缺陷是_________________________________(任写一点)。
(6)反应完全结束后,取出装置C中的混合物先后经加水、加乙醇、过滤、洗涤、干燥等操作得到NaN3固体,其中洗涤操作可用乙醚洗涤NaN3固体的原因___________。
(7)实验室用滴定法测定叠氮化钠产品中NaN3的质量分数:
操作方法:取2.500g产品配制成500.0mL溶液。取25.00mL溶液置于锥形瓶中,加入25.00mL0.1010mol·L-1(NH4)Ce(NO3)6溶液。充分反应后,稍稀释,加入4mL浓硫酸,滴入邻菲罗啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗(NH4)2Fe(SO4)2标准溶液的体积为14.80mL。
测定过程发生反应的方程式为:
2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑
Ce4++Fe2+=Ce3++Fe3+。
产品中NaN3的质量分数为___________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】180℃时将0.5 mol H2和1 mol CO2通入1 L的恒容密闭容器中,反应生成甲醇蒸汽(CH3OH)和某无机副产物,测得各物质的物质的量随时间的部分变化如图所示,下列说法中正确的是

A. 该反应的化学方程式:2CO2+4H2![]() 2CH3OH+O2
2CH3OH+O2
B. 在0~3 min内H2的平均化学反应速率为0.1 mol·L-1·min-1
C. 当容器内混合气体密度不再变化时,表明反应已经达到平衡状态
D. 在3~10 min内,反应仍未达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(![]() )有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
)有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
A. ①②③④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. 全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中,正确的是( )
A. 稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑
B. 稀硫酸与Ba(OH)2溶液混合:SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C. 稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3
D. 氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有关说法正确的是
A. 反应在0~3 s内的平均速率v(NO2)=0.24 mol·L1·s1
B. 在T温度下,起始时向容器中充入1.0mol NO2、0.5mol O3和0.50mol N2O5、0.50mol O2,反应达到平衡时,压强为起始时的0.88倍
C. 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol·L1,则反应的ΔH>0
D. 在T温度下,起始时向容器中充入2.0mol N2O5和2.0mol O2,达到平衡时,N2O5的转化率大于20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:

(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为 。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 (填序号)。
A.适当减缓通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为
6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤。

①滤渣的主要成分为 (填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl2] 1∶5(填“>”、“<”或“=”)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100gL-1,从该溶液中尽可能多地析出KClO3固体的方法是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com