
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 0.2 mol·L-1的NaCl液中含Na+的数目为0.2NA
B. 标准状况下,11.2L水中含有的水分子数目为0.5NA
C. S2和S8的混合物共6.4g,所含硫原子数一定为0.2NA
D. 将100mL0.1mol·L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶体粒子的数目为0.01NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种以2 molL-1的Na2SO4溶液为电解质溶液的钠离子电池的总反应如下(P为+5价):NaTi2(PO4)3+Zn+Na2SO4![]() Na3Ti2(PO4)3+ZnSO4下列有关说法正确的是( )
Na3Ti2(PO4)3+ZnSO4下列有关说法正确的是( )
A. 放电时,NaTi2(PO4)3发生氧化反应
B. 放电时,Na+向锌棒一极移动
C. 充电时,阳极反应式为[Ti2(PO4)3]+-2e-=[Ti2(PO4)3]3+
D. 充电时,每转移0. 2 mol电子,阴极增重6.5 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,按要求完成各小题。
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)元素①的元素符号:_______________
(2)元素⑧的单质电子式_______________
(3)元素⑤的原子结构示意图______________
(4)化学性质最不活泼的元素______(填元素符号,下同),非金属性最强的元素是________。金属性最强的单质_______。
(5)①③⑤三种元素的最高价氧化物水化物中,碱性最强的 _____(填化学式,下同)。①③⑤三种元素的原子半径由大到小的顺序为_____________。
(6)某元素的最高价氧物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素的最高价氧化物和盐酸反应的化学方程式为 _____,与氢氧化钠溶液反应的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定的条件下,下列选项所示的物质间转化均能实现的是
A. SiO2![]() SiCl4
SiCl4![]() Si
Si
B. FeS2![]() SO2
SO2![]() H2SO4
H2SO4
C. N2![]() NH3
NH3![]() NH4Cl(aq)
NH4Cl(aq)
D. MgCO3![]() MgCl2(aq)
MgCl2(aq) ![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下将1 mol N2和3 mol H2置于密闭容器中发生反应N2+3H2![]() 2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
A. 降低温度可以加快反应速率
B. 达到化学反应限度时,生成2mol NH3
C. 向容器中再加入N2可以加快反应速率
D. 1mol N2 和3mol H2的总能量低于2mol NH3的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯乙烷跟化合物之间的转化如图所示:

(1)写出各反应的化学方程式
①__________
②_________
③__________
④__________
(2)根据上述方程式回答下列问题:
①上述化学反应的反应类型有__________,__________,__________。
②用AgNO3溶液通过__________反应可证明卤代烃中含卤元素(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中含酚废水中有机物可用C6H5OH表示,左、中、右室间分别以离子交换膜分隔。下列说法错误的是
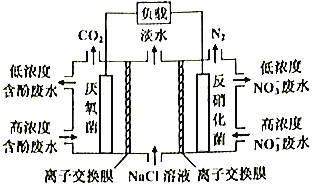
A. 左室电极为该电池的负极
B. 右室电极反应式可表示为:2NO3-+10e-+12H+=N2↑+6H2O
C. 左室电极附近溶液的pH增大
D. 工作时中间室的Cl-移向左室,Na+移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“变废为宝”是化工的重要主题。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有CuCl2,FeCl2等)制备碱式碳酸铜Cu2(OH)2CO3],其制备过程如下图所示:
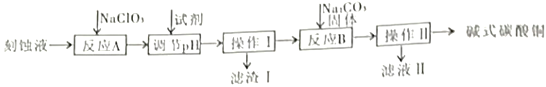
查阅资料得知,一定浓度的Cu2+、Fe2+、Fe3+生成氢氧化物沉淀的pH如下表:
金属离子 | Cu2+ | Fe2+ | Fe3+ |
开始沉淀的pH | 4.2 | 6.5 | 1.4 |
沉淀完全的pH | 6.7 | 9.7 | 3.7 |
(1)电子工业中用FeCl3溶液制作铜制印刷电路板,该反应的离子方程式为___________。
(2)操作I、操作Ⅱ所用的玻璃仪器除烧杯外还需要______________________。
(3)氯酸钠的作用是____________________________________________;反应A中氧化剂与还原剂物质的量之比是___________。
(4)调节pH的范围为___________,可以选择的试剂是___________(填序号)。
A.氨水 B.硫酸铜 C.氧化铜 D.氢氧化铜
(5)已知滤液Ⅱ中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:___________。
(6)若废液中CuCl2的含量为13.5%,则1吨废液理论上可提炼碱式碳酸铜________吨。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com