
| A. | 标准状况下22.4L任意比的氢气和二氧化碳的混合气体中含有的分子总数均为NA | |
| B. | 0.1mol/LNaCl溶液中Na+的数目为0.1NA | |
| C. | 标准状况下,5.6L四氯化碳含有的分子数为0.25NA | |
| D. | 500mL0.2mol/L饱和FeCl3溶液完全转化可制得0.1NA个Fe(OH)3胶粒 |
分析 A、求出混合气体的物质的量,然后根据1mol任何气体中含NA个分子来分析;
B、溶液体积不明确,不能计算微粒数;
C、标况下四氯化碳为液态,标准状况气体摩尔体积为22.4L/mol;
D.氢氧化铁胶体微粒是氢氧化铁的集合体;
解答 解:A、标况下22.4L混合气体的物质的量=$\frac{22.4L}{22.4L/mol}$=1mol,而1mol任何气体中含NA个分子,标准状况下22.4L任意比的氢气和二氧化碳的混合气体中含有的分子总数均为NA,故A正确;
B、溶液体积不明确,故溶液中的钠离子的个数无法计算,故B错误;
C、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D.一个氢氧化铁胶粒是多个氢氧化铁的集合体,故得到的氢氧化铁胶粒的个数小于0.1NA个,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
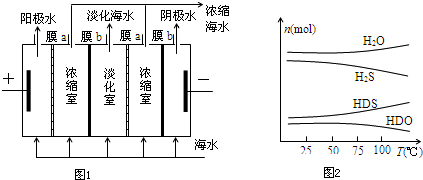
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶可作为袋装食品的干燥剂 | B. | 氨气是生产硝酸的主要原料 | ||
| C. | Fe3O4可用于制备红色油漆、涂料 | D. | NH4HCO3可用作化肥 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HCO3-+CO32-+3H+→2CO2↑+2H2O | B. | HCO3-+3CO32-+7H+→4CO2↑+4H2O | ||
| C. | 2HCO3-+CO32-+4H+→3CO2↑+3H2O | D. | CO32-+H+→HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16:9 | B. | 9:11 | C. | 32:9 | D. | 46:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
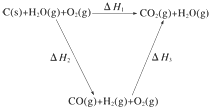 将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);
将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com