
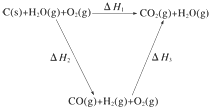
 将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);
将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);分析 (1)根据盖斯定律:①C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol,
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0 kJ/mol,
③CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0 kJ/mol,
根据盖斯定律,①-②-③得;
(2)根据盖斯定律:化学反应不管是一步完成还是分几步完成,其反应热是相同的;也就是说,化学反应的反应热只与反应的始态和终态有关,与反应途径无关.即如果一个反应可以分几步进行,则各步反应的反应热之和与该反应一步完成时的反应热相同;根据煤转化为水煤气要吸收热量.
解答 解:(1)①C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol,
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0 kJ/mol,
③CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0 kJ/mol,
根据盖斯定律,①-②-③得:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ/mol,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ/mol;
(2)化学反应不管是一步完成还是分几步完成,其反应热是相同的;也就是说,化学反应的反应热只与反应的始态和终态有关,与反应途径无关.即如果一个反应可以分几步进行,则各步反应的反应热之和与该反应一步完成时的反应热相同;煤转化为水煤气要吸收热量,
故答案为:乙;甲同学忽略了煤转化为水煤气要吸收热量.
点评 本题主要考查了盖斯定律的应用,难度不大,能准确筛选有用信息是解本题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下22.4L任意比的氢气和二氧化碳的混合气体中含有的分子总数均为NA | |
| B. | 0.1mol/LNaCl溶液中Na+的数目为0.1NA | |
| C. | 标准状况下,5.6L四氯化碳含有的分子数为0.25NA | |
| D. | 500mL0.2mol/L饱和FeCl3溶液完全转化可制得0.1NA个Fe(OH)3胶粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ④⑤⑥ | C. | ②③④ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 1mol氧气约含6.02×1023个O2 | |
| D. | 0.5molH2O含有的原子数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨易溶解于水,因此可用来作喷泉实验 | |
| B. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 | |
| C. | 铵盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处 | |
| D. | 实验室可用氢氧化钠溶液处理含有二氧化硫和氯气的尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.1 | 11.6 | 10.3 | 11.1 | 11.3 |
| A. | CO2+H2O+2NaClO═Na2CO3+2HClO | B. | CO2+H2O+NaClO═NaHCO3+HClO | ||
| C. | CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH | D. | CH3COOH+NaCN═CH3COONa+HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质沸点:X>Y | B. | 阳离子的氧化性:W>Y | ||
| C. | 氧化物对应水化物的酸性:Z>X | D. | Y、Z离子均能抑制水的电离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com