
【题目】已知:N2O4(g)![]() 2NO2(g) △H=+QkJ/mol (Q>0),80℃时在2L密闭容器中充入0.40 mol N2O4,发生反应获得如下数据:
2NO2(g) △H=+QkJ/mol (Q>0),80℃时在2L密闭容器中充入0.40 mol N2O4,发生反应获得如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol/L | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
下列判断正确的是
A. 升高温度会使混合气体的颜色变浅
B. 反应达平衡时,吸收的热量为0.30Q kJ
C. 20~40s内,v(N2O4)=0.004mol/(L·s)
D. 100s时再充入0.40mo1N2O4,达到新平衡时N2O4的转化率增大
【答案】B
【解析】
A.△H=+QkJ/mol(Q>0),表明该反应的正反应为吸热反应,升高温度,化学平衡正向移动,则c(NO2)增大,平衡混合气体的颜色加深,A错误;
B.由表格中数据可知,当反应进行到80s时达到平衡状态,生成NO2的物质的量n(NO2)=0.3mol/L×2L=0.6mol,由于反应的物质的量与热量变化成之比,则反应吸收热量为0.6mol×![]() kJ/mol=0.30QkJ,B正确;
kJ/mol=0.30QkJ,B正确;
C.20~40s内,v(NO2)=![]() =0.004mol/(Ls),根据速率之比等于化学计量数之比,则20~40s内v(N2O4)=0.002 mol/(Ls),C错误;
=0.004mol/(Ls),根据速率之比等于化学计量数之比,则20~40s内v(N2O4)=0.002 mol/(Ls),C错误;
D.100s时再充入0.40molN2O4,由于容器的容积不变,气体的物质的量增多,气体压强增大。增大压强,化学平衡向气体体积减小的逆反应方向移动,因此达到新平衡时N2O4的转化率减小,D错误;
故合理选项是B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在下面的横线上填上适当的内容。
(1)6.02×1024个Na+约含有________mol Na+,其质量为________g。
(2)4.5 mol CH4约含有________个CH4,其质量为________g。
(3)3.01×1023个SO42-约含有________mol SO42-,其质量为________g;49 g H3PO4约含有________个H,________个P,________个O,共含有________个原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景。回答下列问题:
(1)据媒体报道,挪威和荷兰正在开发一种新能源盐能。当海水和淡水混合时,温度将升高0.1℃,世界所有入海口的这种能源相当于电力需求的20%。海水和淡水混合时,温度升高最可能的原因是______。
A.发生了盐分解反应
B.发生了水分解反应
C.由于浓度差产生放热
D.盐的溶解度增大
(2)蒸馏法是人类最早使用的淡化海水的方法。你认为蒸馏法淡化海水最理想的能源是_______。
(3)从海水中可得到多种化工原料和产品,如图是利用海水资源的流程图。

①反应Ⅱ的离子方程式为_________。
②从反应Ⅲ后的溶液中得到纯净的单质溴的实验操作方法是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃ 时,0.1 mo1·L-1某一元酸HA在水中有0.1%发生电离,下列叙述正确的是
A. 该溶液的pH=3
B. 升高温度,溶液的pH增大
C. 此酸的电离方程式为HA=H+ + A-
D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
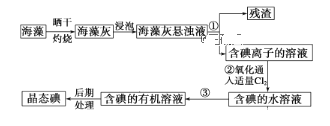
(1)指出提取碘的过程中①的实验操作名称_________及玻璃仪器名称______________________________________。
(2)写出过程②中有关反应的离子方程式:_____________________。
(3)操作③的名称_____________,用到的主要仪器_____________。
(4)提取碘的过程中,可供选择的有机试剂是(______)。
A.酒精 B.四氯化碳 C.甘油 D.醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备乙酸乙酯的装置,如图所示,回答下列问题:

(1)乙醇、乙酸和浓硫酸混合顺序应为_____________________。
(2)收集乙酸乙酯的试管内盛有的饱和碳酸钠溶液的作用是____________________。
(3)反应中浓硫酸的作用________________________________。
(4)反应中乙醇和乙酸的转化率不能达到100%,原因是_______________________。
(5)收集在试管内的乙酸乙酯是在碳酸钠溶液的________层。
(6)该反应的化学方程式为______________________。
(7)将收集到的乙酸乙酯分离出来的方法为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出):

取17.1 g A放入装置中,通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(1)通入过量O2的目的______________________。
(2)C装置的作用是_____________________________。D装置的作用是_____________________。
(3)通过该实验,能否确定A中是否含有氧原子?__________。
(4)若A的摩尔质量为342 g/mol,C装置增重9.90 g,D装置增重26.4 g,则A的分子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol) P—P:198,P—O:360,O=O:498,则反应P4(白磷)+3O2![]() P4O6
P4O6

A. 放出1 638 kJ热量
B. 吸收1 638 kJ热量
C. 放出126 kJ热量
D. 吸收126 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL含HCl的AlCl3溶液中逐滴加入0.1mol·L-1的NaOH溶液,加入NaOH溶液的体积V(mL)与产生Al(OH)3沉淀的物质的量n(mol)的关系如图:

试计算:(请写出运算过程)
(1)原溶液中HCl的物质的量浓度。____________
(2)原溶液中AlCl3的物质的量浓度。____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com