
(8分)已知在250C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:
(1)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 ___ (填“>”、“<”或“=”)570 kJ
(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:A、B两个电极均由多孔的碳块组成。该电池的正极为:__________(填A或B)。若该电池工作时增加了1mol H2O,电路中转移电子的物质的量为 ____________ mol 。
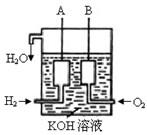
(3)写出电极反应式A: ; B: ;
(1)< (2)B 2
(3)A:负极:2H2-4e- +4OH- =4H2O;(或H2-2e- +2OH- =2H2O)
B:正极O2+4e- +2H2O=4OH-;
【解析】(1)由于水蒸气的能量高于液态水的能量,所以氢气燃烧生成气体水时放出的热量少。
(2)原电池中正极是得到电子的,而负极是失去电子的,所以氢气在负极通入,氧气在正极通入。根据方程式2H2+O2=2H2O可知,每生成1mol水转移电子是2mol。
(3)AB分别通入的是氢气和氧气,由于电解质是氢氧化钾,所以电极反应式为负极:2H2-4e- +4OH- =4H2O、正极O2+4e- +2H2O=4OH-。


科目:高中化学 来源: 题型:
(1)写出苹果酸的结构简式:___________________________。
(2)在苹果酸的同分异构体中,符合上述①②两个条件的有(写出结构简式):______________。
(3)写出苹果酸+乙醇+乙酸在浓H2SO4作用下的化学方程式:___________________________。
(4)苹果酸可以发生如下转化:
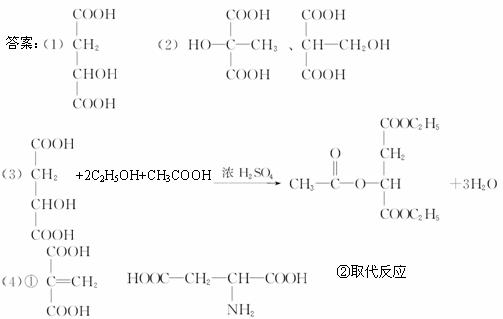
已知B为四元环状结构;C能使溴水褪色,E是组成人体蛋白质的氨基酸之一,其分子式为C4H7O4N。
①写出与C具有相同官能团的同分异构体的结构简式_________和E的结构简式_________。
②D![]() E的反应类型是_________。
E的反应类型是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
目前国内兴起喝一种酸性保健饮品——主要成分是苹果酸。苹果酸在分离提纯后的化学分析如下:①相对分子质量不超过250,完全燃烧后只生成CO2和H2O;分子中C的质量分数:35.82%,H的质量分数4.48%。②1 mol该酸与足量的NaHCO3反应放出44.8 L CO2,与足量的Na反应放出33.6 L H2(气体体积均在标准状况下测下);③该分子中存在四种化学环境不同的碳原子,氢原子也处于四种不同的化学环境中。
(1)写出苹果酸的结构简式:___________________________。
(2)在苹果酸的同分异构体中,符合上述①②两个条件的有(写出结构简式):______________。
(3)写出苹果酸+乙醇+乙酸在浓H2SO4作用下的化学方程式:___________________________。
(4)苹果酸可以发生如下转化:

已知B为四元环状结构;C能使溴水褪色,E是组成人体蛋白质的氨基酸之一,其分子式为C4H7O4N。
①写出与C具有相同官能团的同分异构体的结构简式_________和E的结构简式_________。
②D![]() E的反应类型是_________。
E的反应类型是_________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南通市高三第三次模拟化学试卷(解析版) 题型:填空题
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
|
物质 |
CH4 |
CO2 |
CO |
H2 |
|
体积分数 |
0.1 |
0.1 |
0.4 |
0.4 |
①此温度下该反应的平衡常数K= 。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H=2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g)
的△H= 。
2CO(g)+2H2(g)
的△H= 。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。

②为了提高该反应中CH4的转化率,可以采取的措施是 。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为 。
(3)以CO2为原料可以合成多种物质。
①聚碳酸酯是一种易降解的新型合成材料,它是由加聚而成。写出聚碳酸酯的结构简式: 。
②以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南通、泰州、扬州连云港淮安高三第三次调研5月测试化学卷(解析版) 题型:填空题
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
⑴250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol
CH4,发生如下反应:CO2 (g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
|
物质 |
CH4 |
CO2 |
CO |
H2 |
|
体积分数 |
0.1 |
0.1 |
0.4 |
0.4 |
①此温度下该反应的平衡常数K= 。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H=2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g)
的△H= 。
2CO(g)+2H2(g)
的△H= 。
⑵以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。

②为了提高该反应中CH4的转化率,可以采取的措施是 。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为 。
⑶以CO2为原料可以合成多种物质。
①聚碳酸酯是一种易降解的新型合成材料,它是由缩聚而成。写出聚碳酸酯的结构简式: 。
②以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)
草酸(H2C2O4)是一种重要的化工原料。已知常温下0.01 mol·L-1的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示。
| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.0 | 3.1 | 8.1 、 |
(1)在其它条件不变时,下列措施能使KHC2O4溶液中c(K+)∶c(HC2O4-)接近1∶1的是_________(填字母)。
A.加入适量的H2C2O4 B.加入适量的KHC2O4
C.加入适量的Na2C2O4 D.升高溶液的温度
(2)取一定质量H2C2O4·2H2O和KHC2O4的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-1 NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol·L-1 H2SO4溶液酸化后,用0.10mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
①完成离子方程式:5C2O42-+2Mn04-+16H+ =10______+2Mn2++8H2O。
②原混合物中H2C2O4·2H2O和KHC2O4的物质的量之比为__________。
(3)某实验小组用如图所示的装置探究FeC2O4·2H2O在隔绝空气条件下受热分解的产物。当36.0g FeC2O4·2H2O充分反应后,残留固体质量为13.6g,浓硫酸增重7.2g,碱石灰增重11.0g。求残留固体的成分和物质的量。(已知FeC2O4·2H2O的相对分子质量为180;设反应产生的气体被充分吸收)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com