
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6nsl,回答下列问题。
(1)该配位化合物的化学式为____ 。元素B、C、D的第一电离能由大到小的排列顺序为 。 (用元素符号表示)
(2)D元素原子的最外层电子排布图为 。DC42-的立体构型为____ 。
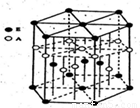
(3)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。则该化合物的化学式为 该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。
(1)[Cu(NH3)4]SO4·H2O N>O>S;
(2)  正四面体;
正四面体;
(3)CuH 2CuH+3Cl2 2CuCl2+2HCl
2CuCl2+2HCl
【解析】
试题分析:(1) 某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1。则A、B、C、D、E五种元素分别为H、 N、 O、 S、 CU ,所对应的的蓝色晶体为[Cu(NH3)4]SO4·H2O ;O、N属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N、O;O、S属于同一主族元素且原子序数依次增大,同一主族元素的第一电离能随着原子序数的增大而减小,所以第一电离能由大到小:N>O>S;(2)根据能量最低原理和核外电子排布规律,不难写出硫元素核外电子排布图;SO42-中心原子S含有4δ键,孤电子对数为:0,价层电子对数为4,杂化类型为SP3,空间构型为正四面体型。(3)根据均摊法分析,Cu原子:12×+2×+2=5,H原子:6×+3=5,则该物质化学式为CuH;棕黄色烟为氯化铜固体,无色气体为氯化氢气体,结合反应物和产物不难写出相关化学方程式。
考点:本题考查较为综合,涉及电子排布式、晶胞计算、电离能以及配合物知识,题目难度中等,注意配合物的分析和积累。


科目:高中化学 来源: 题型:
 某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6nsl,回答下列问题.
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6nsl,回答下列问题.查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川成都树德中学高三第三次理综测试化学试卷(解析版) 题型:填空题
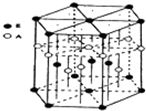
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6nsl,回答下列问题。
(1)该配位化合物的化学式为 。元素B、C、D的第一电离能由大到小的排列顺序为_______(用元素符号表示)。
(2)D元素原子的最外层电子排布图为 ,DC42-的立体构型为 。
(3)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。
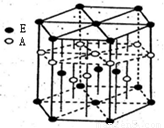
则该化合物的化学式为 ,该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com