
【题目】下列依据热化学方程式得出的结论正确的是( )
A.已知2H2(g)+O2(g)=2H2O(g);△H=﹣483.6 kJmol﹣1氢气的燃烧热为241.8 kJmol﹣1
B.已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l);△H=﹣57.4 kJmol﹣1 , 则含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ/mol的热量
C.已知C(石墨,s)=C(金刚石,s);△H>0 则石墨比金刚石稳定
D.己知C(s)+O2(g)=CO2(g);△H1C(s)+1/2O2(g)=CO(g);△H2 , 则△H1>△H2
【答案】C
【解析】解:A.选项中生成的水是气体,应该是液态水,所以不能得出氢气的燃烧热是241.8 kJ/mol,故A错误; B.已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l)△H=﹣57.4 kJ/mol,则含20.0g NaOH物质的量为0.5mol的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,故B错误;
C.已知C(石墨,s)=C(金刚石,s)△H>0,反应是吸热反应,石墨能量低于金刚石,能量越低越稳定,所以石墨比金刚石稳定,故C正确;
D.已知C(s)+O2(g)=CO2(g)△H1①,C(s)+ ![]() O2(g)=CO(g)△H2 ②,①﹣②得到:CO(g)+
O2(g)=CO(g)△H2 ②,①﹣②得到:CO(g)+ ![]() O2(g)=CO2(g)△H1﹣△H2 , 一氧化碳燃烧生成二氧化碳是放热反应,焓变是负值,所以△H1<△H2 , 故D错误,
O2(g)=CO2(g)△H1﹣△H2 , 一氧化碳燃烧生成二氧化碳是放热反应,焓变是负值,所以△H1<△H2 , 故D错误,
故选C.


科目:高中化学 来源: 题型:
【题目】下列有关氯的说法正确的是
A. Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B. 1.12LCl2含有1.7NA个质子(NA表示阿伏加德罗常数)
C. 氯水放置数天后,酸性增强
D. 常温下干燥的Cl2能用钢瓶贮存,原因为Cl2在任何情况下均不与铁反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下面的实验一和实验二,探究某些化学理论.
(1)实验一:以反应2Fe3++2I﹣=2Fe2++I2为例, 探究该反应是否为可逆反应.
实验方法:在KI溶液中滴加3mLFeCl3溶液,将混合液均
匀分到甲、乙、丙三支试管中;往试管甲中滴加淀粉
溶液,往试管乙中滴加KSCN溶液.如图所示: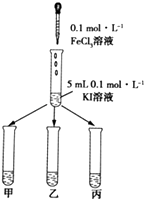
若试管甲中出现现象;
乙试管中出现现象,
则说明该反应为可逆反应.
(2)实验二:实验室制备CO2的反应.实验过程中的数据及相关信息如下表:
序号 | 反应温度/℃ | C(HCl)/molL﹣1 | V(HCl)/mL | 10g碳酸钙的形状 | t/min |
① | 20 | 2 | 10 | 块状 | t 1 |
② | 20 | 4 | 10 | 块状 | t 2 |
③ | 20 | 2 | 10 | 粉末 | t 3 |
④ | 40 | 2 | 10 | 粉末 | t 4 |
⑤ | 40 | 4 | 10 | 粉末 | t5 |
※t表示收集相同状况下体积都为a mL CO2所需的时间※
(i)由表格中的信息可知实验二的目的是探究
(ii)实验①和实验②是探究对该化学反应速率的影响,分析表格中的信息可知,对该化学反应速率的影响因素还有
(iii)收集a mL CO2所需的时间最少的实验是(填实验序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D表示中学化学中的四种常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去). 
(1)若A为强碱溶液,其焰色反应显黄色,C常用作食品添加剂,请回答下列问题:
①物质的量浓度相同的B、C水溶液的pH前者(填大于或小于)后者.
②反应Ⅲ的离子方程式是 .
③现有B和C的固体混合物ag,加热至质量不再改变时剩余固体为bg,则B的质量分数为 .
(2)若C、D均为金属单质,向A溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则:①反应 III的离子方程式是 .
②实验室中储存B溶液时应加入 .
③检验溶液A中金属阳离子的方法是 .
(3)若D为强电解质、B为难溶于水的沉淀,
①则A和C反应的离子方程式
②符合条件的D物质可能是下列物质中的(填序号).
a.硫酸 b.醋酸 c.氢氧化钠 d.氨水 e.氯化钡 f.硝酸镁.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知向FeCl2溶液中滴加稀硝酸,溶液颜色由浅绿色变为棕黄色.某同学用此反应设计了如图所示原电池. 
(1)写出FeCl2与稀硝酸反应的离子方程式 .
(2)图中电子流动方向为极到极.
(3)在乙烧杯中会观察到的现象为 , 写出乙烧杯中的电极反应方程式 .
(4)H+流向烧杯,若一段时间内流向该烧杯的H+有0.05mol,则消耗Fe2+g
(5)该装置存在的缺点可能是(写一点)
(6)若将乙烧杯的稀硝酸换成浓硝酸,写出a电极上的电极反应方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学模拟工业制碘的方法,探究ClO3﹣和I﹣的反应规律.实验操作及现象如表:
实验及试剂 | 编号 | 无色NaClO3 | 试管中 | 淀粉KI |
| 1 | 0.05 mL | 浅黄色 | 无色 |
2 | 0.20 mL | 深黄色 | 无色 | |
3 | 0.25 mL | 浅黄色 | 蓝色 | |
4 | 0.30 mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如图实验: 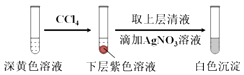
经检验,上述白色沉淀是AgCl.写出加入0.20mL NaClO3后,溶液中ClO3﹣和I﹣发生反应的离子方程式: .
(2)查阅资料:一定条件下,I﹣和I2都可以被氧化成IO3﹣ .
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)
中的反应产物继续反应,同时生成Cl2 .
进行实验:
①取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3﹣ . 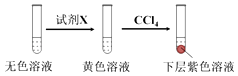
其中试剂X可以是(填字母序号).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2 , 便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33molL﹣1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是 , 进一步佐证实验4中生成了Cl2 . 获得结论:NaClO3溶液用量增加导致溶液褪色的原因是(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
编号 | 6.0 molL﹣1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25 mL | 浅黄色 | 无色 |
6 | 0.85 mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是 .
②用离子方程式解释实验6的现象: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷有剧毒,白磷中毒可用硫酸铜溶液解毒,白磷与硫酸铜可以发生如下两个反应:
1)2P+5CuSO4+8H2O═5Cu+2H3PO4+5H2SO4
2)11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4
下列有关说法中错误的是( )
A.上述两个反应中,水既不是氧化剂也不是还原剂
B.上述两个反应中,氧化产物都是H3PO4
C.反应(2)中,1mol CuSO4可氧化1/5molP
D.上述两个反应中,氧化剂都只有硫酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去CO2气体中的SO2气体,下列对于仪器和药品组合中合理的是
仪器:①洗气瓶②干燥管; 药品:③固态生石灰④饱和苏打溶液⑤饱和小苏打溶液
A. ①⑤ B. ②⑤ C. ①③ D. ①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com