
【题目】除去括号内杂质所用试剂和方法不正确的是
A. CO2(HCl)—氢氧化钠溶液,洗气 B. KNO3(NaCl)—溶解,蒸发浓缩,冷却结晶,过滤
C. 水(NaCl)—蒸馏 D. Cu(Fe)—溶于足量盐酸,过滤
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】冬天使用的热敷袋里面有铁粉、氯化钠、碳粉,利用铁被氧化放出的热量取暖.某同学拆开一袋后取里面的固体粉末进行实验:
①将粉末投入盛有足量稀盐酸的烧杯中,观察到有大量气泡产生,底部有黑色粉末.则发生反应的离子方程式为 .
②为分离出反应后的溶液,可将上述烧杯中混合物进行操作,该操作需要的玻璃仪器为 .
③在②得到的溶液中通入氯气,发生如下离子反应:2Fe2++Cl2=2Fe3++2Cl─;在该离子方程式中,当有ag氧化产物生成时,需通入标准状况下的氯气体积为L(用含a的代数式表示).
④该同学将少量铜片投入制得的含FeCl3的溶液中,发现铜片慢慢溶解消失,溶液由黄色变为青绿色.则发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液中可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下实验:
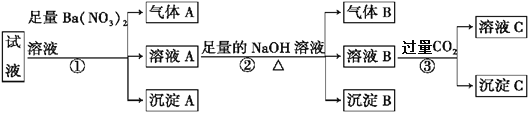
下列有关判断不正确的是
A. 原溶液中一定有Fe2+、SO42-、H+、NH4+、Al3+
B. 原溶液中一定没有Ba2+、CO32-、NO3-
C. 步骤③中反应的离子方程式为2AlO2-+CO2+3H2O2Al(OH)3↓+ CO32-
D. 气体A、B之间能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.除去苯中含有的少量苯酚,可在混合物中加入足量NaOH后分液
B.戊烷(C5H12)有两种同分异构体
C.乙烯、聚氯乙烯和苯分子均含有碳碳双键
D.乙烯、聚乙烯、苯均能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
从以上表格中判断以下说明中不正确的是( )
A. 在冰醋酸中这四种酸都没有完全电离
B. 在冰醋酸中高氯酸是这四种酸中最强的酸
C. 在冰醋酸中硫酸的电离方程式为H2SO4===2H++SO42-
D. 水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有__________。
A.使用过量的CO B.升高温度 C.增大压强
(3)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是___________。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是___________。
A.△H <0
B.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
C. △S<0
D.P1<P2<P3
(4)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为___________时最有利于二甲醚的合成。
(5)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为__________

(6)甲醇液相脱水法制二甲醚的原理是:CH3OH +H2SO4→CH3HSO4+H2O,CH3 HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含硫酸铜、硫酸亚铁、硫酸铁的混合溶液100 mL,已知溶液中各种阳离子的物质的量相等,硫酸根离子的浓度为7 mol·L-1。此溶液最多能溶解铁粉的质量为
A. 5.6 g B. 10.6 g C. 11.2 g D. 16.8 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com