
| A. | 反应中Cu2S只做还原剂 | |
| B. | 参加反应的n(Cu2S):n(HNO3)=1:5 | |
| C. | 产物n[Cu(NO3)2]:n[CuSO4]=1:1 | |
| D. | 1 molCu2S参加反应时有10 mol电子转移 |
分析 由信息可知,n(NO2):n(NO)=1:1,假定生成1molNO2、1molNO;则HNO3被还原生成1molNO2、1molNO共得4mole-;Cu2S应失4mole-.而1molCu2S能失10mole-,故失4mole-说明反应的Cu2S的物质的量为0.4mol,0.4molCu2S生成0.4molCuSO4和0.4molCu(NO3)2;即起酸性作用的HNO3的物质的量为0.8mol,起氧化作用的HNO3为2mol.反应的HNO3共2.8mol,故n(Cu2S):n(HNO3)=0.4mol:2.8mol=2:14,则发生2Cu2S+14HNO3=2Cu(NO3)2+2CuSO4+5NO2↑+5N0↑+7H2O,Cu、S元素的化合价升高,N元素的化合价降低,结合化学方程式的定量关系和氧化还原反应关系分析判断.
解答 解:A.Cu、S元素的化合价升高,则Cu2S做还原剂,故A正确;
B.由2Cu2S+14HNO3=2Cu(NO3)2+2CuSO4+5NO2↑+5N0↑+7H2O可知,参加反应的n(Cu2S):n(HNO3)=2:14,故B错误;
C.由发生的反应可知,产物n[Cu(NO3)2]:n[CuSO4]=1:1,故C正确;
D.1 molCu2S参加反应时有1mol×2×(2-1)+1mol×[6-(-2)]=10mol电子转移,故D正确;
故选B.
点评 本题考查氧化还原反应,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,综合性较强,题目难度中等大.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
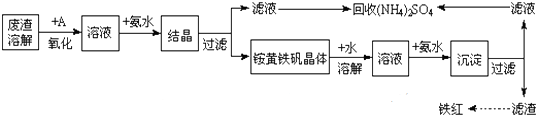
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌锰干电池工作一段时间后碳棒变细 | |
| B. | 氢氧燃料电池可将热能直接转变为电能 | |
| C. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| D. | 氢氧燃料电池工作时氢气在负极被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
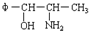 将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )
将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )| A. | 5 | B. | 7 | C. | 8 | D. | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O | |
| B. | CH3CHBrCH3+NaOH$→_{△}^{乙醇}$CH3CH═CH2↑+NaBr+H2O | |
| C. | 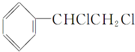 +2NaOH$→_{△}^{乙醇}$ +2NaOH$→_{△}^{乙醇}$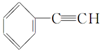 +2NaCl+2H2O +2NaCl+2H2O | |
| D. | 2CH3OH$→_{△}^{浓硫酸}$CH3-O-CH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
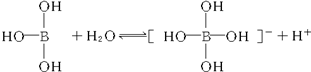
| A. | 凡是酸或碱对水的电离都是抑制的 | |
| B. | 硼酸分子中除氢原子外每个其他原子最外层都满足8电子稳定结构 | |
| C. | 硼酸溶液与NaOH溶液反应的离子方程式为:H3BO3+OH-═[B(OH)4]- | |
| D. | 硼酸是两性化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A组 | B组 |
| Ⅰ.H-I键键能大于H-Cl键能 Ⅱ.H-I键键能小于H-Cl键能 Ⅲ.HI分子间作用力大于HCl分子间作用力 Ⅳ.HI分子间作用力小于HCl分子间作用力 | a.HI比HCl稳定 b.HCl比HI稳定 c.HI沸点比HCl高 d.HI沸点比HCl低 |
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com