
分析 Ⅰ.实验①:取少量KI溶液于试管中,先加入溴水,振荡.再加入CCl4,振荡后静置,观察到下层液体呈紫红色,说明有碘单质生成,说明Br2的氧化性强于I2,实验②:取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈血红色,说明有Fe3+生成,也就可以说明Br2的氧化性强于Fe3+,
(1)实验②中亚铁离子被溴氧化成铁离子,根据电荷守恒和元素书写离子方程式;
(2)根据实验①有Br2的氧化性强于I2,实验②有Br2的氧化性强于Fe3+;
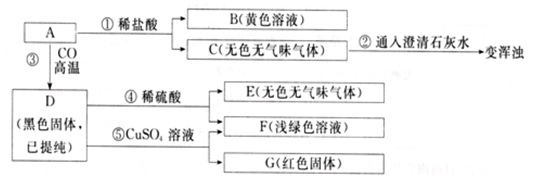
Ⅱ.A中加入盐酸,生成黄色溶液和一种气体.由溶液为黄色说明溶液中一定含有铁离子.气体C能使澄清的石灰水变浑浊,所以C为二氧化碳.由固体颜色为红色可知A中一定含有碳酸钙和氧化铁.
A与一氧化碳高温得黑色固体,所以黑色固体D为铁.加入稀硫酸生成气体E为氢气.铁与硫酸铜反应生成浅绿色溶液为硫酸亚铁,和红色固体铜,以此解答该题.
解答 解:Ⅰ.(1)验②中亚铁离子被溴氧化成铁离子,反应的离子方程式为2Fe2++Br2=2Fe3++2Br-,
故答案为:Fe2++Br2=2Fe3++2Br-;
(2)根据实验①有Br2的氧化性强于I2,实验②有Br2的氧化性强于Fe3+,故答案为:AC;
Ⅱ.(1)由以上分析可知A含有碳酸钙、氧化铁,则含有的原子团为CO32-,黄色说明溶液中一定含有铁离子,则溶质为FeCl3,
故答案为:CO32-;FeCl3;
(2)②为二氧化碳与澄清石灰水的反应,方程式为CO2+Ca(OH)2=CaCO3↓+H2O,⑤为铁与硫酸铜的反应,方程式为Fe+CuSO4=Cu+FeSO4,
故答案为:CO2+Ca(OH)2=CaCO3↓+H2O;Fe+CuSO4=Cu+FeSO4.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析能力的考查,注意把握物质的性质以及反应的现象,题目还涉及氧化性的比较,需具备一定的实验能力和综合思维能力,尤其是氧化性、还原性强弱的判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol碳完全燃烧放出的热大于110.5 kJ | |
| B. | ①的焓变为221 kJ•mol-1 | |
| C. | 浓硫酸与稀NaOH溶液完全反应生成1 mol水时放热为57.3 kJ | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+ | B. | SO32- | C. | SiO32- | D. | Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{92}^{235}$U与${\;}_{92}^{238}$U互为同素异形体 | |
| B. | ${\;}_{92}^{235}$U与${\;}_{92}^{238}$U互为同位素 | |
| C. | ${\;}_{92}^{235}$U原子核中含有92个中子 | |
| D. | ${\;}_{92}^{235}$U原子核外有143个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 离子反应与复分解反应属于包含关系 | |
| B. | 化合物与电解质属于包含关系 | |
| C. | 金属氧化物与碱性氧化物属于交叉关系 | |
| D. | 氧化还原反应与化合反应属于并列关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体氯化钠不导电,所以氯化钠不是电解质 | |
| B. | 氯化氢水溶液能导电,所以氯化氢是电解质 | |
| C. | SO2溶于水能导电,所以SO2是电解质 | |
| D. | 氨水能导电,所以氨水是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com