
【题目】下列过程中发生了取代反应的是( )
A. 苯加入溴水中,振荡并静置后下层液体变为无色
B. 在催化剂作用下乙烯生成聚乙烯
C. 在铜催化、加热条件下,乙醇与氧气反应
D. 乙醇和乙酸在浓硫酸作用下加热生成乙酸乙酯
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】实验室可用酒精、浓硫酸作试剂来制取乙烯,但实验表明,还有许多副反应发生,如反应中会生成SO2、CO2、水蒸气等无机物。某研究性学习小组欲用下图所示的装置制备纯净的乙烯并探究乙烯与单质溴能否反应及反应类型。回答下列问题:
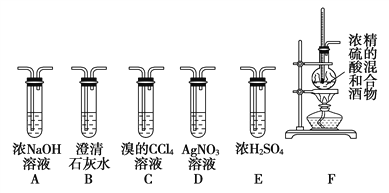
(1)写出制备乙烯反应的化学方程式:________________________,实验中,混合浓硫酸与乙醇的方法是将___________慢慢加入另一种物质中;加热F装置时必须使液体温度______________。
(2)为实现上述实验目的,装置的连接顺序为F→__________,_______,_______,
_______→D (各装置限用一次),B装置的作用是_________________。
(3)当C中观察到____________________时,表明单质溴能与乙烯反应;若D中_________________,表明C中发生的是取代反应;若D没有出现前面所描述的现象时,表明C中发生的是_______________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当光束通过下列分散系:①有尘埃的空气 ② 稀硫酸 ③蒸馏水④ 豆浆,能观察到丁达尔效应的是( )
A. ①② B. ②③
C. ①④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3·5H2O)俗称“海波”,又名“大苏打”,在纺织工业中用于棉织品漂白后的脱氯剂、染毛织物的硫染剂、靛蓝染料的防白剂、纸浆脱氯剂、医药工业中用作洗涤剂、消毒剂和褪色剂等,它易溶于水,难溶于乙醇,加热易分解,具有较强的还原性和配位能力。它是冲洗照相底片的定影剂,棉织物漂白后的脱氯剂,定量分析中的还原剂。工业上常用亚硫酸钠法、硫化碱法等制备。
(1)某实验室模拟工业硫化碱法制取(2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2)硫代硫酸钠,其反应装置及所需试剂如下图,a的装置名称为________,装置c的作用是________________________________________________________________________。

(2)工业上还可以用亚硫酸钠法(亚硫酸钠和硫粉通过化合反应)制得,装置如下图所示。

已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如下图所示。

Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后,检查A、C装置气密性的操作是___________________________。
步骤2:加入药品,打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热。写出烧瓶内发生反应的化学方程式:_________________________________________________________。
装置B、D的作用是__________________。
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH接近7时,打开K2、关闭K1并停止加热;C中溶液要控制pH的理由是_______________________________________________________________。
步骤4:过滤C中的混合液,将滤液经过__________________________、冷却结晶、过滤、洗涤、烘干,得到产品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。

已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气的体积比的方法是_____________________________________。
②使用多孔球泡的作用是__________________________________________。
(2)①装置B中产生Cl2O的化学方程式为__________________________________________。
②若B无冷却装置,进入C中的Cl2O会大量减少。其原因是___________________________。
(3)装置C中采用棕色圆底烧瓶是因为______________________________________________。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中所得次氯酸溶液的物质的量浓度的实验方案:用_________量取20.00 mL次氯酸溶液于烧杯中,_________________________________________________________________________________________________________。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于锌铜—稀硫酸原电池的叙述,正确的是( )
A. 氢离子在铜表面被氧化,产生气泡
B. 溶液中的阴离子SO42-移向负极
C. 电子经导线从负极流向正极,再经溶液从正极流向负片
D. 金属铜参与了电极反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中能大量共存的是
A. 无色溶液中:K+、Na+、MnO4—、SO42—
B. 在酸性溶液中:Ba2+、Na+、SO42—、Cl—
C. 加入Al能放出H2的溶液中:Cl—、HCO3—、SO42—、NH4+
D. 含大量Fe2+溶液中:K+、Cl—、SO42-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2、CO是处理方法对环境保护用重要意义。
(1)已知:①CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41kJ·mol-1
CO(g)+H2O(g) △H=+41kJ·mol-1
②C(g)+2H2(g)![]() CH4(g) △H=-73kJ·mol-1
CH4(g) △H=-73kJ·mol-1
③2CO(g)![]() C(g)+CO2(g) △H=-171kJ·mol-1
C(g)+CO2(g) △H=-171kJ·mol-1
则CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H=__________。
CH4(g)+2H2O(g) △H=__________。
(2)CO2与H2反应可合成甲醇:CO2(g)+3H2(g)![]() CH4(g)+H2O(g)
CH4(g)+H2O(g)
某温度下,将1molCO2和3molH2充入探究不变的2L密闭容器中,发生上述反应。测得不同时刻的反应前后压强关系如下:
时间(h) | 1 | 2 | 3 | 4 | 5 | 6 |
P后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
①用CO2表示第1小时反应的平均速率v(CO2)=_______mol·L-1·h-1。
②该温度下的H2平衡转化率为______________。
(3)CO2与NH3反应可合成尿素:CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
在T1℃时,将1molCO2和2molNH3置于1L密闭容器中,发生上述反应,在t时刻,测得容器中CO2转化率约为73%。保护其他初始实验条件不变,分别在温度为T2℃、T3℃、T4℃、T5℃时,重复上述实验,经过相同时间测得CO2转化率并绘制变化曲线如图所示:

①该反应的△H______0(填“>”或“<”)
②T4℃时该反应的平衡常数K=___________。
③在T1℃~T3℃之间,CO2转化率逐渐增大,其原因是____________________。
(4)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示
img src="http://thumb.zyjl.cn/questionBank/Upload/2018/01/02/09/ce4caee6/SYS201801020935301407189654_ST/SYS201801020935301407189654_ST.003.png" width="212" height="154" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />
①阳极区产生CO2的原因是______________(用离子方程式表示)。
②利用平衡移动原理,简述CO32-在阴极区再生的原因_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com