(1)中国古代四大发明之一--黑火药,它的爆炸反应为:
2KNO
3+3C+S
A+N
2↑+3CO
2↑(已配平)
①除S外,上列元素的电负性从大到小依次为
O>N>C>K
O>N>C>K
.
②在生成物中,A的晶体类型为
离子晶体
离子晶体
,含极性共价键的分子的中心原子轨道杂化类型为
sp杂化
sp杂化
.
③已知CN
-与N
2为等电子体,推算HCN分子中σ键与π键数目之比为
1:1
1:1
.
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2.T的基态原子外围电子(价电子)排布为
3d84s2
3d84s2
,Q
2+的未成对电子数是
4
4
.
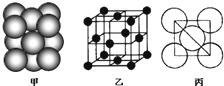
(3)若某金属单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.则晶胞中该原子的配位数为
12
12
,该单质晶体中原子的堆积方式为四种基本堆积方式中的
铜型
铜型
.
(4)在CrCl
3的水溶液中,一定条件下存在组成为[CrCl
n(H
2O)
6-n]
x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCl
n(H
2O)
6-n]
x++xR-H-→R
x[CrCl
n(H
2O)
6-n]
x++xH
+交换出来的H
+经中和滴定,即可求出x和n,确定配离子的组成.将含0.0015mol[CrCl
n(H
2O)
6-n]
x+的溶液,与R-H完全交换后,中和生成的H
+需浓度为0.1200mol?L
-1NaOH溶液25.00mL,可知该配离子的化学式为
[CrCl(H2O)5]2+
[CrCl(H2O)5]2+
,中心离子的配位数为
6
6
.

 科学实验活动册系列答案
科学实验活动册系列答案
