
| 0.25mol |
| 5mol/L |


科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.把1molNaCl溶于1L水中所得溶液物质的量浓度为1mol/L |
| B.把0.1molNaCl投入100mL容量瓶中加水至刻度线,充分振荡后,浓度为1mol/L |
| C.容量瓶用蒸馏水洗净后,再用待配液润洗 |
| D.需要98mL,1mol/L的Na2CO3溶液,应称取Na2CO3固体10.6克 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.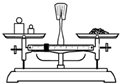 称量 | B.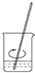 溶解 | C.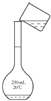 转移 | D. 定容 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.取100 mL 5mol/LH2SO4,加入400mL水 |
| B.取200 mL 5mol/LHCl,加水稀释至500mL |
| C.取100mL 5mol/LH2SO4,加水稀释至500mL |
| D.取100mL 5mol/LHNO3,加水稀释至500mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com