
【题目】现有反应aA(g)+bB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是________热反应,且a+b________p(填“>”“<”或“=”)。
(2)减压时,A的质量分数________(填“增大”“减小”或“不变”,下同),正反应速率________。
(3)若加入B(体积不变),则A的转化率________,B的转化率________。
(4)若升高温度,则平衡时,B、C的浓度之比![]() 将________。
将________。
(5)若加入催化剂,平衡时气体混合物的总物质的量________。
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色________,而维持容器内气体的压强不变,充入氖气时,混合物的颜色________(填“变浅”“变深”或“不变”)。
【答案】(1)放 > (2)增大 减小 (3)增大 减小
(4)减小 (5)不变 (6)变深 变浅
【解析】升高温度,B的转化率变大,说明此反应的正反应为吸热反应;减小压强,混合体系中C的质量分数变小,说明减小压强时平衡向逆反应方向移动,则a+b>p。(1)该反应的逆反应是放热反应,且a+b>p。(2)因为a+b>p,则减压时平衡逆向移动,A的质量分数增大,反应物浓度减小则正反应速率减小。(3)若加入B,则平衡正向移动,A的转化率增大,B的转化率减小。(4)若升高温度,平衡正向移动,![]() 减小。(5)催化剂对化学平衡无影响。(6)若B为有色物质,体积不变时加入C,平衡向逆反应方向移动,生成更多的B而使混合物的颜色加深;如维持容器内压强不变,充入氖气可使容器体积增大,虽然平衡向逆反应方向移动,B的物质的量增加,但B的浓度比原平衡时小,因而混合物的颜色变浅。
减小。(5)催化剂对化学平衡无影响。(6)若B为有色物质,体积不变时加入C,平衡向逆反应方向移动,生成更多的B而使混合物的颜色加深;如维持容器内压强不变,充入氖气可使容器体积增大,虽然平衡向逆反应方向移动,B的物质的量增加,但B的浓度比原平衡时小,因而混合物的颜色变浅。


科目:高中化学 来源: 题型:
【题目】25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是:( )
A. c(NH4+)=c(SO42-) B. c(NH4+)>c(SO42-)
C. c(NH4+)<c(SO42-) D. c(OH-)+c(SO42-) = c(NH4+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.反应NH3(g)+HCl(g)![]() NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
B.CaCO3(s)![]() CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
C.一定温度下,反应MgCl2(l)![]() Mg(l)+Cl2(g)的ΔH>0、ΔS>0
Mg(l)+Cl2(g)的ΔH>0、ΔS>0
D.常温下,反应C(s)+CO2(g)![]() 2CO(g)不能自发进行,则该反应的ΔH>0
2CO(g)不能自发进行,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校课外活动小组在实验室中制备Fe(OH)3胶体,方法是:①将蒸馏水加热煮沸;②向沸水中滴加 。③煮沸至溶液呈红褐色,停止加热。回答下列问题:
(1)步骤②中滴加的试剂是_____________________________。
(2)该反应的化学方程式为_______________________________________________。
(3)往制得的Fe(OH)3胶体中插入两个惰性电极,通直流电一段时间后发现阴极附近颜色____。这种现象称为______________。
(4)向其中加入过量稀硫酸,发生的现象是___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如下图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
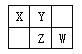
请回答下列问题:
(1)元素Z位于周期表中的位置_____________________。
(2)X、Y、Z三种元素的最高价氧化对应水化物中酸性由强到弱依次为________________(写化学式)。
(3)X和Y形成一种有毒的二元化合物,其相对分子质量在50~60之间,且其分子式中X的质量分数约为46%,该化合物的分子式为__________,该分子中各原子最外层均满足8电子稳定结构,其结构式为 ___________.
(4)写出W的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式_____________,
反应中若转移12mol电子,消耗的还原剂质量为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3是重要的工业原料,课外小组以SO2为原料制取Na2S2O3的实验步骤如下:
I. 配制混合溶液
将Na2S和Na2CO3按2:1的物质的量之比混合,加入一定量的水,形成溶液。
II.预热、充分反应
将该溶液注入敞口反应釜中,加热反应釜一段时间,向反应釜中缓慢通入SO2至稍过量。
III.蒸发浓缩、冷却结晶
反应结束后加热浓缩溶液,冷却至30℃以下,析出大量Na2S2O3 5H2O。
IV.过滤、循环反应
滤出Na2S2O3 5H2O,烘干脱去结晶水,母液循环利用。
回答下列问题:
(1)步骤II预热时温度不宜过高,应将温度控制在50℃左右,其主要目的是____________。
(2)步骤II充分反应时的化学方程式为_______________________。
(3)步骤IV中的母液循环利用,其目的是在节约成本、减少污染的同时,提高________。
(4)为测定所得Na2S2O3产品的纯度,称取w g烘干后的Na2S2O3产品,先用适量蒸馏水溶解,再用a mol L-1碘的标准溶液滴定(2S2O32-+I2=2I-+S4O62-,且不考虑杂质与碘反应),以淀粉溶液作指示剂,滴定至终点时的现象为_________________。
若消耗碘的标准溶液的体积为b mL,则所得产品的纯度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧气可发生如下反应:P4+5O2![]() P4O10。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol1、P—O b kJ·mol1、P=O c kJ·mol1、O=O d kJ·mol1。根据如图所示的分子结构和有关数据估算该反应的ΔH,下列数据正确的是
P4O10。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol1、P—O b kJ·mol1、P=O c kJ·mol1、O=O d kJ·mol1。根据如图所示的分子结构和有关数据估算该反应的ΔH,下列数据正确的是

A.(6a+5d4c12b) kJ·mol1
B.(4c+12b6a5d) kJ·mol1
C.(4c+12b4a5d) kJ·mol1
D.(4a+5d4c12b) kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是

A. 该反应的化学方程式为6A+2 D![]() 3B+4C
3B+4C
B. 0~1 s,v(A)=v(B)
C. 反应进行到5 s时,B的平均反应速率为0.06mol/(L·s)
D. 反应进行到5 s时,v(A)=v(B)=v(C)=v(D)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com