
下列实验设计能够成功的是
A.检验亚硫酸钠试样是否变质:
试样 白色沉淀
白色沉淀 沉淀不溶解
沉淀不溶解 说明试样已变质
说明试样已变质
B.除去粗盐中含有的硫酸钙杂质
粗盐




 精盐
精盐
检验某溶液中是否含有Fe2+
试样 溶液颜色无变化
溶液颜色无变化 溶液变红色
溶液变红色 溶液中含有Fe2+
溶液中含有Fe2+
D.明酸性条件H2O2的氧化性比I2强:
NaI溶液
 溶液变蓝色
溶液变蓝色 氧化性:H2O2>I2
氧化性:H2O2>I2
科目:高中化学 来源: 题型:单选题
下列实验操作正确的是
| A.实验室制备乙酸乙醋时,往浓硫酸中缓慢加入乙醇和冰醋酸的混合液 |
| B.实验室制备干燥纯净的氯气时,气体先通过饱和食盐水再通过浓硫酸 |
| C.检验溶液中C1一和SO42-,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液 |
| D.检验FeC12溶液中Fe2+先加入氯水再滴加少量KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关实验原理.方法和结论都正确的是( )
| A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 |
| B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| C.室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡.静置后分液,可除去苯中少量苯酚 |
D.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用下列装置进行相应实验,能达到目的的是
| A.用图1装置除去C12中少量的HCl |
| B.用图2装置蒸干NH4Cl饱和溶液制取NH4Cl晶体 |
| C.用图3装置制取纯净的CO2气体 |
| D.用图4装置分离CCl4萃取碘水后的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关乙烯和苯燃烧的说法不正确的是
| A.点燃前都要检验纯度 | B.质量相同时,消耗的氧气不同 |
| C.燃烧时都会产生黑烟 | D.充分燃烧,都产生二氧化碳和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
乙烯中混有SO2气体,欲除去SO2,得到较纯净的乙烯,最好依次通过下列哪组试剂的洗气瓶( )
| A.酸性KMnO4溶液、浓H2SO4 | B.溴水、浓H2SO4 |
| C.浓H2SO4、酸性KMnO4溶液 | D.NaOH溶液、浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(17分)(2012?广东)难溶性杂卤石(K2SO4?MgSO4?2CaSO4?2H2O)属于“呆矿”,在水中存在如下平衡
K2SO4?MgSO4?2CaSO4?2H2O(s)?2Ca2++2K++Mg2++4 +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1: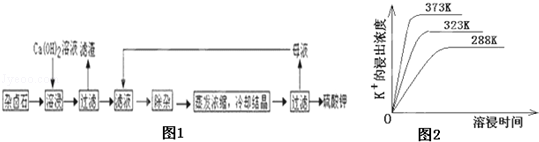
(1)滤渣主要成分有 和 以及未溶杂卤石.
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因: .
(3)“除杂”环节中,先加入 溶液,经搅拌等操作后,过滤,再加入 溶液调滤液PH至中性.
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,① ② ;
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+ ?CaCO3(s)+
?CaCO3(s)+
已知298K时,Ksp(CaCO3)=2.80×10﹣9,Ksp(CaSO4)=4.90×10﹣5,求此温度下该反应的平衡常数K (计算结果保留三位有效数字).
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
(1)步骤③的离子方程式: 。
(2)步骤⑤中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是 。
(3)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过 (填试剂名称)溶液,以除去氯气。
(4)步骤⑤的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因: 。
(5)步骤①中用硫酸酸化可提高Cl2的利用率,理由是 。
(6)提取溴单质,采用蒸馏“溴水混合物Ⅱ”而不是蒸馏“溴水混合物Ⅰ”,请说明原因: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com