
| 1 |
| 2 |
| 2x |
| 4-2x |
| 2 |
| 3 |
3×
| ||
| 3 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
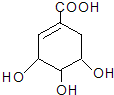 八角茴香是中国传统的香料和中药,八角茴香含有一种重要成分莽草酸,莽草酸是目前世界上被证明是对抗禽流感的唯一良方--“达菲”的原材料.它的结构简式为:下列关于莽草酸的说法正确的是( )
八角茴香是中国传统的香料和中药,八角茴香含有一种重要成分莽草酸,莽草酸是目前世界上被证明是对抗禽流感的唯一良方--“达菲”的原材料.它的结构简式为:下列关于莽草酸的说法正确的是( )| A、该化合物不能使溴水褪色 |
| B、该化合物可以与FeCl3溶液发生显色反应 |
| C、莽草酸的分子式为C7H8O5 |
| D、该化合物可以发生消去反应,但不可以被催化氧化生成醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 对人类发展的贡献 | 对人类发展带来的问题 | 化学界的解决办法 |
| 硫酸铵等化肥 | 农作物增产数倍,解决了人类的粮食问题 | 造成赤潮、土壤酸化等 问题 | 合理使用化学肥料 |
| 塑料 | 解决包装等材料问题,有效减少了木材和金属等资源的消耗 | 产生了“白色污染” | 研究新型可降解塑料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgNO3保存在棕色试剂瓶里 |
| B、Li保存在煤油里 |
| C、用pH试纸测得某盐酸溶液的pH为2.3 |
| D、液溴保存在带橡胶塞的玻璃瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com