

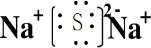 ,故答案为:
,故答案为: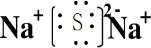 ;
;| 催化剂 |
| △ |
| 催化剂 |
| △ |


科目:高中化学 来源: 题型:
| A、碳氢化合物的通式为CnH2n |
| B、石油的主要成份是碳氢化合物 |
| C、碳氢化合物都是气体 |
| D、碳氢化合物中的化学键都是极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过滤 | B、蒸发 | C、升华 | D、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若V1>V2,则说明HA的酸性比HB的酸性强 |
| B、若V1>V2,则说明HA的酸性比HB的酸性弱 |
| C、若中和所得混合液的pH前者大于后者,则V1>V2 |
| D、若中和所得混合液的pH前者小于后者,则V1>V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煅烧石灰石可得生石灰和二氧化碳,该反应是一个放出能量的反应 |
| B、水分解产生氢气和氧气时放出能量 |
| C、相同状况下,反应2SO2+O2═2SO3是一个放热反应,则反应2SO3═2SO2+O2是一个吸热反应 |
| D、氯化氢分解成氢气和氯气时需要吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(NaOH) |
| n[NH4Al(SO4)2] |
| x取值 | 反应的离子方程式 | Al元素存在形式 |
| x<3 | ||
| 2NH4++2Al3++9OH-=2NH3?H2O+Al(OH)3↓+AlO2-+2H2O | ||
| AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
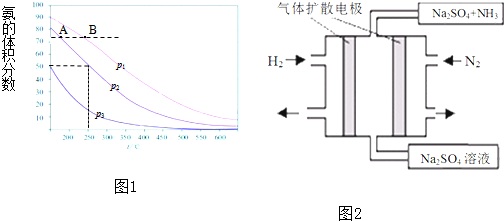
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、反应速率v正(X)=
| ||
| B、加入X,反应的△H增大 | ||
| C、增加Y的物质的量,X的转化率增大 | ||
D、降低温度,
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com