
| A、若V1>V2,则说明HA的酸性比HB的酸性强 |
| B、若V1>V2,则说明HA的酸性比HB的酸性弱 |
| C、若中和所得混合液的pH前者大于后者,则V1>V2 |
| D、若中和所得混合液的pH前者小于后者,则V1>V2 |


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:
| A、除去KCl中的少量MgCl2:加入适量NaOH溶液,过滤 |
| B、除去FeCl2中的少量FeCl3:加入足量铁屑,充分反应后过滤 |
| C、检测同条件H3PO4和 H2SO4溶液酸性强弱,比较磷和硫两元素非金属性的强弱. |
| D、向无色溶液加BaCl2溶液,生成白色沉淀,加稀HNO3,沉淀不消失,该溶液一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、门捷列夫、居里夫妇、诺贝尔、爱因斯坦 |
| B、门捷列夫、诺贝尔、居里夫妇、爱因斯坦 |
| C、爱因斯坦、门捷列夫、诺贝尔、居里夫妇 |
| D、爱因斯坦、门捷列夫、居里夫妇、诺贝尔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、WX4是天然气的主要成分 |
| B、固态X2Y中含有氢键 |
| C、Y的气态氢化物比Z的气态氢化物稳定 |
| D、WY2与ZY2的晶体类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
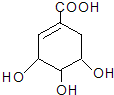 八角茴香是中国传统的香料和中药,八角茴香含有一种重要成分莽草酸,莽草酸是目前世界上被证明是对抗禽流感的唯一良方--“达菲”的原材料.它的结构简式为:下列关于莽草酸的说法正确的是( )
八角茴香是中国传统的香料和中药,八角茴香含有一种重要成分莽草酸,莽草酸是目前世界上被证明是对抗禽流感的唯一良方--“达菲”的原材料.它的结构简式为:下列关于莽草酸的说法正确的是( )| A、该化合物不能使溴水褪色 |
| B、该化合物可以与FeCl3溶液发生显色反应 |
| C、莽草酸的分子式为C7H8O5 |
| D、该化合物可以发生消去反应,但不可以被催化氧化生成醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com