
| A.此法的优点之一是原料来源丰富 |
| B.进行①、②、③步操作的目的是从海水中提取氯化镁 |
| C.第④步电解时会产生氯气 |
| D.以上提取镁的过程中涉及的反应有分解反应、化合反应、复分解反应和置换反应 |
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验探究内容 | 实验用品 |
| A | 铜丝在氯气中燃烧 | 坩埚钳、燃烧匙、氯气、铜丝 |
| B | 铝热反应 | 铁架台、大蒸发皿、普通漏斗、铝粉、Fe2O3 |
| C | 实验室制备氨气 | 试管、集气瓶、酒精灯、NH4Cl、Ca(OH)2 |
| D | 用KMnO4晶体配制500mL0.1mol·L-1KMnO4溶液 | 容量瓶、烧杯、玻璃棒、酸式滴定管、KMnO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
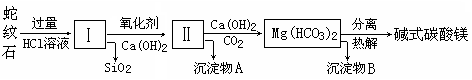
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
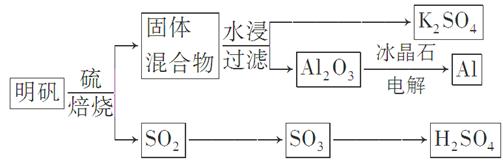 焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O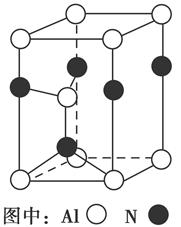
 2SO3(g) ΔH1=-197 kJ/mol;
2SO3(g) ΔH1=-197 kJ/mol;查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
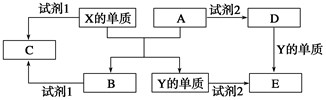
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.5.4g | B.3.6g | C.2.7g | D.1.8g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com