


 2Na3AlF6+3CO2+9H2O
2Na3AlF6+3CO2+9H2O

科目:高中化学 来源:不详 题型:单选题
| A.此法的优点之一是原料来源丰富 |
| B.进行①、②、③步操作的目的是从海水中提取氯化镁 |
| C.第④步电解时会产生氯气 |
| D.以上提取镁的过程中涉及的反应有分解反应、化合反应、复分解反应和置换反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
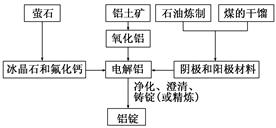
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
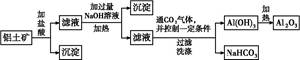
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
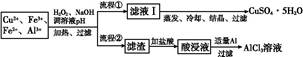
| 离子 | Fe3+ | Fe2+ | Al3+ | Cu2+ |
| pH范围 | 2.2~3.2 | 5.5~9.0 | 4.1~5.0 | 5.3~6.6 |
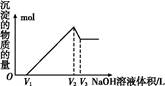
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
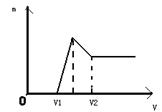
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com