
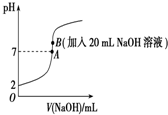
 25℃下,向20mL 0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示,请回答下列问题:
25℃下,向20mL 0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示,请回答下列问题:分析 (1)HF酸中存在HF?F-+H+,为使电离度增大,应使平衡正向移动;
(2)由图象可知0.2mol•L-1的氢氟酸的pH=2,则c(H+)=0.01mol/L,以此可计算电离常数;
(3)根据溶液显中性,说明氢离子和氢氧根的物质的量一定相等;
(4)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素.
解答 解:(1)HF酸中存在HF?F-+H+,为使电离度增大,应使平衡正向移动,
A.升高温度,可使平衡正向移动,电离常数或电离度增大,故A正确;
B.向溶液中滴入2滴浓盐酸,氢离子浓度增大,平衡向着逆向移动,HF的电离程度减小,故B错误;
C.加入少量NaF固体,氟离子浓度增大,平衡逆向移动,电离度减小,故C错误,
D.加水稀释会促使电离平衡正向移动,使电离度增大,故D正确;
故答案为:AD;
(2)由图象可知0.2mol•L-1的氢氟酸的pH=2,则c(H+)=0.01mol/L,可知电离的c(HF)为0.01mol/L,
K=$\frac{c({F}^{-})•c({H}^{+})}{c(HF)}$=$\frac{0.01×0.01}{0.2-0.01}$≈5.3×10-4,
故答案为:5.3×10-4;
(3)pH=a的盐酸的物质的量浓度为10-amol/L,pH=b的NaOH溶液的物质的量浓度为10b-14mol/L,混合后恰好呈中性,则10-amol/L×Va L=10b-14mol/L×Vb L,整理可得:Va:Vb=10a+b-14,
故答案为:10a+b-14;
(4)一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,根据电离能的变化规律,半充满的N原子和全充满的Be原子第一电离能要比同周期原子序数大的原子高,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素,
故答案为:3.
点评 本题考查较为综合,涉及酸碱混合的定性判断及溶液pH的计算、第一电离能的应用、电离平衡常数的计算、弱电解质的电离平衡及其影响,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,(4)为易错点,注意N和Be原子的第一电离能特点.


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:选择题
| A. | 烧碱可做食品干燥剂 | B. | 经常接触铅笔芯易造成铅中毒 | ||
| C. | 盐类都可以用作调味品 | D. | 蚕丝的主要成分是蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | a | b | c | d | e |
| n(SO2)/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
| t/min | 2 | 5 | 8 | 15 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,B的氢化物易溶于C的氢化物中,D的基态原子s轨道与p轨道上的电子数之比为2:3,且D为主族元素;E、F为副族元素,4s能级均只有一个电子.回答下列问题:
A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,B的氢化物易溶于C的氢化物中,D的基态原子s轨道与p轨道上的电子数之比为2:3,且D为主族元素;E、F为副族元素,4s能级均只有一个电子.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com