
【题目】镍、铂、镧等过渡金属单质及化合物在医疗领域有着广泛的应用。
(1)基态原子镍的价电子排布式为_______。
(2)抗癌药奥沙利铂(又名乙二酸铂)的结构简式如图所示。

①分子中氮原子轨道的杂化类型是_________,C、N、O三种元素的第一电离能由大到小的顺序为_____。
②1 mol乙二酸分子中含有σ键的数目为________________。
(3)碳酸镧[La2(CO3)3]可用于治疗高磷血症。写出与CO32-互为等电子体的一种分子的化学式: _______。
(4)镧镰合金可用于储氢,储氢之后所得晶体的化学式为LaNi5(H2)3,其晶体的最小重复结构单元如图所示(◎、O、●代表储氢之后晶体中的三种微粒)。图中●代表的微粒是_______。

【答案】 3d84s2 sp3 N>O>C 7NA SO3 H2
【解析】(1)Ni的原子序数为28,电子排布式为1s22s22p63s23p63d84s2,则价电子排布式是3d84s2;(2) ①抗癌药奥沙利铂分子中氮原子价电子数=![]() ,为sp3杂化;C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N>O>C;②单键都是σ键,双键中其一个是σ键一个是π键,1个乙二酸分子一共7个σ键,2个π键,故1 mol乙二酸分子中含有σ键的数目为7NA;(3)等电子体是指具有相同价电子数目和原子数目的分子或离子,与CO32-互为等电子体的分子的化学式为:SO3;(4)根据均摊法计算,◎的个数为8×
,为sp3杂化;C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N>O>C;②单键都是σ键,双键中其一个是σ键一个是π键,1个乙二酸分子一共7个σ键,2个π键,故1 mol乙二酸分子中含有σ键的数目为7NA;(3)等电子体是指具有相同价电子数目和原子数目的分子或离子,与CO32-互为等电子体的分子的化学式为:SO3;(4)根据均摊法计算,◎的个数为8×![]() =1,O的个数为8×
=1,O的个数为8×![]() +1=5,●的个数为8×
+1=5,●的个数为8×![]() +1=3,根据化学式LaNi5(H2)3可知,图中●代表的微粒是H2。
+1=3,根据化学式LaNi5(H2)3可知,图中●代表的微粒是H2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某温度下,纯水中c(H+)=2×10﹣7 molL﹣1 , 则此温度下水的离子积为 . 若温度不变,滴入稀盐酸使c(H+)=5×10﹣4 molL﹣1 , 则此时c(OH﹣)= . 由水电离产生的c(H+)为 , 此时温度(填“高于”、“低于”或“等于”)25°C.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化工产品,硫酸的用量被视为一个国家工业发达水平的一种标志。反应2SO2+O2![]() 2SO3是工业制取硫酸的主要反应之一,下列说法不正确的是( )
2SO3是工业制取硫酸的主要反应之一,下列说法不正确的是( )
A. 该反应为可逆反应,在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫
B. 达到平衡后,反应就停止了,正、逆反应速率相等且都为零
C. 在利用上述反应生产三氧化硫时,要考虑适当增大化学反应速率
D. 在利用上述反应生产三氧化硫时,要考虑使尽可能多的二氧化硫转化为三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤直接作为燃料燃烧,不但热效率较低,且产生烟尘、二氧化硫、氮的氧化物等,带来严重的环境污染。煤干馏是提高煤利用率、生产重要化工原料、降低污染物排放量的有效措施之一。
某化学学习小组在实验室条件下探究煤干馏的现象及产物,装置如下,请回答有关问题:
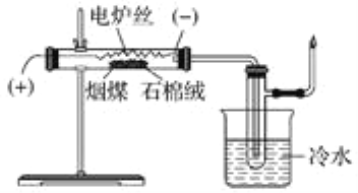
(1)煤干馏的条件是________________________________________________________
(2)盛有冷水的烧杯的作用是________________________________________________。
(3)实验后检验生成粗氨水的操作是_________________________________________。
(4)已知一氧化碳不能使溴水褪色,若将具支试管出来的气体通入溴水中,发现溴水褪色,则说明产生了_____________________________________________________________。
(5)检验具支试管出来的气体的性质后,将尾气点燃,火焰的颜色为______________。
(6)从煤焦油中分离出苯及其同系物的实验方法是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化锶(SrO2·2H2O)晶体是一种白色粉末,微溶于水,常用作焰火的引火剂。制备流程如下:

反应原理![]() 该反应放热.
该反应放热.
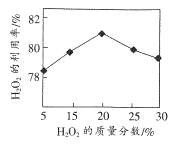
(1)选择不同浓度的双氧水在反应器中反应,测得相同时间H2O2的利用率随浓度的变化关系如右图所示。5%的H2O2比20%的H2O2利用率低的原因是____。
(2)SrO2.2H2O遇CO2会反应变质,反应的化学方程式为___。
(3)25℃时,将Sr(NO3)2溶液滴加到含有F一、CO32-的溶液中,当混合溶液中c(Sr2+)= 0.0010 mol/L时,同时存在SrF2、SrCO3两种沉淀,则此时溶液中c(F-):c(CO32-)=__。
(4)准确称取1.8000 g SrO2·2H2O样品置于锥形瓶中,加入适量的盐酸使之充分转化为H2O2,再加入足量KI摇匀后置于暗处,充分反应后,加入少量淀粉试液,用1.0000 moI/L Na2S2O3标准溶液滴定到蓝色恰好消失时,共消耗标准溶液20.00 mL,计算SrO2·2H2O样品的纯度,写出计算过程__________。(已知:Ksp(SrF2)=4.0×10-9,Ksp(SrCO3)=5.0×10-9)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案的设计与评价合理的是 (_____)
A | B | C | D |
|
|
|
Ⅰ为Al电极,其他均为Cu电极 |
| 验证氧化性:Cl2>Br2>I2 | 验证温度对平衡移动的影响 | 电子流动方向:电极Ⅳ→A→电极Ⅰ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对溴苯乙烯( ![]() )与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点.完成下列填空:
)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点.完成下列填空:
(1)写出该共聚物的结构简式 .
(2)实验室由乙苯制取对溴苯乙烯,需先经两步反应制得中间体 ![]() . 写出该两步反应所需的试剂及条件 , .
. 写出该两步反应所需的试剂及条件 , .
(3)将 ![]() 与氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色.A的结构简式为 . 由A生成对溴苯乙烯的反应条件为 .
与氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色.A的结构简式为 . 由A生成对溴苯乙烯的反应条件为 .
(4)丙烯催化二聚得到2,3﹣二甲基﹣1﹣丁烯,B与2,3﹣二甲基﹣1﹣丁烯互为同分异构体,且所有碳原子处于同一平面.写出B的结构简式 .
(5)设计一条由2,3﹣二甲基﹣1﹣丁烯制备B的合成路线 . (合成路线常用的表示方式为:A ![]() B…
B… ![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学探究SO2使品红溶液褪色的过程,将SO2通入水中得到pH=2的溶液A,后续操作如下,下列说法不正确的是
实验1 |
|
实验2 |
|
A. 溶液A的pH=2原因是:SO2 + H2O![]() H2SO3
H2SO3 ![]() H+ + HSO3-
H+ + HSO3-
B. 实验1、实验2均体现了SO2的还原性和漂白性
C. 经实验1、2对比可知品红溶液褪色的过程是可逆的
D. 实验2中加入NaOH溶液调节pH =2 的原因是排除H+浓度变化产生的干扰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com