
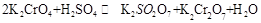
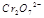 在水溶液中为红色,
在水溶液中为红色,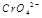 在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。
在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。 ;
;
 ,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用
,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用 来生产甲醇燃料的方法,该方法的化学方程式是:
来生产甲醇燃料的方法,该方法的化学方程式是: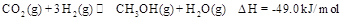
 和8molH
和8molH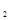 充入一容积为2L的密闭容器中,测得H
充入一容积为2L的密闭容器中,测得H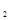 的物质的量随时间变化如右图中实线所示(
的物质的量随时间变化如右图中实线所示( 图中字母后数字表示对应的坐标):
图中字母后数字表示对应的坐标):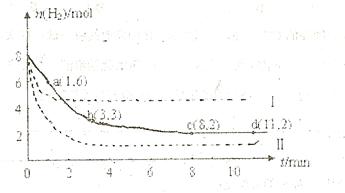
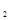 的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是
的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是 体的密度不再改变
体的密度不再改变 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.196.46 kJ | B.55.175 kJ |
| C.141.285 kJ | D.282.57 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

 则1 mol C与
则1 mol C与 反应生成CO的反应热
反应生成CO的反应热 H为
H为A.-(2.5x -0.5 y)  | B.-(5x - 0.5y)   |
C.-(10x - y)  | D.- y  |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.A―→F ΔH=-ΔH6 |
| B.A―→D ΔH=ΔH1+ΔH2+ΔH3 |
| C.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0 |
| D.ΔH1+ΔH6=ΔH2+ΔH3+ΔH4+ΔH5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

 (2) 2Ag(s)+1/2O2(g) = Ag2O(s) △H =-31.0 kJ/mol
(2) 2Ag(s)+1/2O2(g) = Ag2O(s) △H =-31.0 kJ/mol 则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的△H等于( )
则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的△H等于( )
| A.-317.3 kJ/mol | B.-379.3 kJ/mol |
| C.-332.8 kJ/mol | D.317.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.─484KJ/moL | B.+484KJ/moL | C.─242KJ/moL | D.+242KJ/moL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 完全燃烧,放出热量650 kJ。将反应后的二氧化碳气体缓缓通入到含有0.5 mol Ca (OH)2的澄清石灰水中充分反应。所得溶液为 。
完全燃烧,放出热量650 kJ。将反应后的二氧化碳气体缓缓通入到含有0.5 mol Ca (OH)2的澄清石灰水中充分反应。所得溶液为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-317.3kJ·mol-1 | B.-379.3kJ·mol-1 | C.-332.8kJ·mol-1 | D.+317.3kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 +1/2O2(g) ="=CO(g);" △H=-110.5 kJ/mol
+1/2O2(g) ="=CO(g);" △H=-110.5 kJ/mol 1/2O2(g)==H2O(g); △H=-241.8 kJ/mol
1/2O2(g)==H2O(g); △H=-241.8 kJ/mol O2(g)==16CO2(g)+18H2O(l); △H=-11036 kJ/mol
O2(g)==16CO2(g)+18H2O(l); △H=-11036 kJ/mol 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com