
【题目】水合肼(N2H4·H2O) 是一种强还原剂,沸点118.5℃,熔点-40℃,常温下为无色透明的油状液体,属于二元弱碱,在空气中可吸收CO2而产生烟雾。水合肼的制备装置如图。
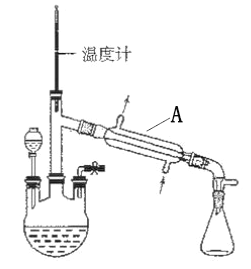
(1)装置A的名称为________________。向三颈烧瓶中加入溶液之前,应先从右侧导管中通入氮气,目的是______________________。
(2)水合肼可用含NaOH 的NaClO溶液氧化尿素[CO(NH2)2]溶液制得,反应的化学方程式为__________________。
(3)制备水合肼时,分液漏斗应盛装________(填标号)。理由是___________。
a.NaOH 和NaClO 混合溶液 b.CO(NH2)2 溶液
(4)弱酸性条件下水合肼可处理电镀废水,将Cr2O72-还原为Cr(OH)3沉淀而除去,水合肼被氧化为N2,该反应的离子方程式为_____________。常温下Ksp[Cr(OH)3]= 10-32,且当溶液中离子浓度小于10-5mol/L时可视作沉淀完全。则Cr3+沉淀完全时,溶液的pH=________。
(5)有同学认为该实验收集装置有缺陷。请你写出改进措施:______________。
【答案】 直形冷凝管 排出空气,避免水合肼与空气中的CO2反应 CO(NH2)2+2NaOH+NaClO===N2H4·H2O+Na2CO3+NaCl a 如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化 (或防止反应生成的水合肼会被次氯酸钠氧 2Cr2O![]() +4H++3N2H4·H2O===4Cr(OH)3↓+3N2↑+5H2O 5 在牛角管后加一个装有碱石灰的干燥管
+4H++3N2H4·H2O===4Cr(OH)3↓+3N2↑+5H2O 5 在牛角管后加一个装有碱石灰的干燥管
【解析】(1)根据图示,装置A为直形冷凝管。向三颈烧瓶中加入溶液之前,应先从右侧导管中通入氮气,排出空气,避免水合肼与空气中的CO2反应,故答案为:直形冷凝管;排出空气,避免水合肼与空气中的CO2反应;
(2)水合肼可用含NaOH的NaClO溶液氧化尿素[CO(NH2)2]溶液制得,反应的化学方程式为CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl,故答案为:CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl;
(3) 如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化,因此制备水合肼时,分液漏斗应盛装NaOH和NaClO混合溶液,故答案为:a;如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化;
(4)弱酸性条件下水合肼可处理电镀废水,将Cr2O72-还原为Cr(OH)3沉淀而除去,水合肼被氧化为N2,反应的离子方程式为2Cr2O72-+4H++3N2H4·H2O===4Cr(OH)3↓+3N2↑+5H2O,常温下Ksp[Cr(OH)3]=10-32,且当溶液中离子浓度小于10-5mol/L时可视作沉淀完全。则Cr3+沉淀完全时,c(OH-)=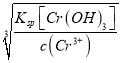 =
=![]() =10-9mol/L,溶液的pH=5,故答案为:2Cr2O72-+4H++3N2H4·H2O=4Cr(OH)3↓+3N2↑+5H2O;5;
=10-9mol/L,溶液的pH=5,故答案为:2Cr2O72-+4H++3N2H4·H2O=4Cr(OH)3↓+3N2↑+5H2O;5;
(5)水合肼(N2H4·H2O)是一种强还原剂,属于二元弱碱,在空气中可吸收CO2而产生烟雾,因此在牛角管后加一个装有碱石灰的干燥管,防止空气中的二氧化碳进入装置,故答案为:在牛角管后加一个装有碱石灰的干燥管。


科目:高中化学 来源: 题型:
【题目】为研究金属腐蚀的条件和速率,某课外小组学生用金属丝将三根大小相同的铁钉分别固定在图示的三个装置中,再放置于玻璃钟罩内保存一星期后,下列对实验结束时现象描述不正确的是( )

A. 装置Ⅰ左侧的液面一定会上升 B. 左侧液面装置Ⅰ比装置Ⅱ的低
C. 装置Ⅱ中的铁钉腐蚀最严重 D. 装置Ⅲ中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用NaOH溶液吸收尾气中的H2S气体,再将得到的Na2S溶液进行电解制得NaOH溶液,以实现NaOH的循环利用。电解装置如图所示,电极材料均为石墨,ab、cd均为离子交换膜。下列叙述不正确的是
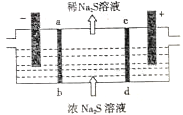
A. ab表示阳离子交换膜,cd表示阴离子交换膜
B. 阳极的电极反应式为S2--2e-==S↓,阳极区有淡黄色沉淀产生
C. 阴极的电极反应式为2H2O-4e-==O2↑+4H+,阴极区溶液pH降低
D. 当电路中转移1mol电子时,会有11.2L(标准状况)的气体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二醛(OHC-CHO)化学性质活泼,是纺织工业中常用的一种有机原料,能增加棉花、尼龙等纤维的防缩性和防皱性。其工业生产方法主要是乙二醇(HOCH2CH2OH)气相催化氧化法和乙醛液相硝酸氧化法。请回答下列相关问题:
(1)乙二醇气相催化氧化法
以乙二醇、氧气为原料,在催化剂存在的条件下,250℃左右开始缓慢进行,生成乙二醛和副产物乙醇酸[CH2(OH)COOH]的反应方程式:
I.HOCH2CH2OH(g)+O2(g) ![]() OHC-CHO(g)+2H2O(g)△H1
OHC-CHO(g)+2H2O(g)△H1
II.HOCH2CH2OH(g)+O2(g) ![]() CH2(OH)COOH(g)+H2O(g)△H2
CH2(OH)COOH(g)+H2O(g)△H2
已知反应I中相关化学键键能数据如下:
化学键 | C-H | C-O | H-O | O==O | C==O | C-C |
E/kJ·mol-1 | 413 | 343 | 465 | 498 | 728 | 332 |
①△H1=_____kJ/mol,反应I的化学平衡常数表达式为K=________。
②欲提高I的平衡产率,可以采取的措施是______(填标号)。
A.升高温度 B.增大压强 C.降低温度 D.减小压强
③提高乙二醛反应选择性的关键因素是_________________________。
④保持温度和容积不变,下列描述能说明反应I达到平衡状态的是________(填标号)。
A.v正(O2)=2v逆(H2O)
B.混合气体的压强不再随时间变化而变化
C.混合气体的密度不再发生变化
D.乙二醇与OHC-CHO的物质的量之比为1:1
E.混合气体中乙二醛的体积分数不再发生变化
(2)乙醛(CH3CHO)液相硝酸氧化法
11.0g40%的乙醛溶液和40%的硝酸,按一定比例投入氧化反应釜内,在Cu(NO3)2催化下,控制温度在38~40℃时,反应10h,再通过萃取等操作除去乙醛、硝酸等,最后经减压浓缩得4.35g40%乙二醛溶液。
①用稀硝酸氧化乙醛制取乙二醛时,有N2O产生。其化学方程式为______________________。
②利用上面数据,计算乙二醛的产率为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL、0.1mol/L的NaOH溶液中加入0.1mol/L的HA溶液,溶液pH的变化曲线如图所示。下列说法正确的是( )
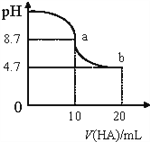
A. pH=7时,c(Na+)= c(A-)+c(HA)
B. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
C. b点所示溶液中:c(A-)>c(HA)
D. a、b两点所示溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为研究电化学原理,设计右图装置。下列叙述正确的是( )
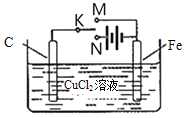
A. K与M相连时,每转移1mol电子Fe表面生成32gCu
B. K与N相连时,碳棒上产生使湿润的淀粉-KI试纸变蓝的气体
C. K分别与M、N相连时,铁均受到保护
D. K与M、N均断开,一段时间后电解质溶液质量变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,探究铜与稀HNO3,反应过程如下:
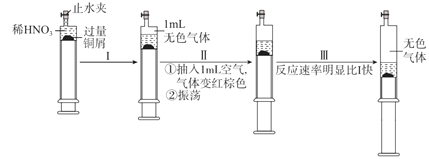
下列说法不正确的是
A. 过程I中生成无色气体的离子方程式是3Cu+2 NO3-+8H+ =3Cu2++2NO↑+4H2O
B. 步骤III反应速率比I快的原因是NO2溶于水,使c(HNO3)增大
C. 由实验可知,NO2对该反应具有催化作用
D. 当活塞不再移动时,再抽入空气,铜可以继续溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X是一种具有果香味的合成香料,如图所示为合成X的一种流程。 E是日常生活中常见的一种有机物,碳、氢的质量分数分别约为52.17% 、13.04% ,其余为氧,E的相对分子质量为46,其中含有甲基和亚甲基(—CH2—)。
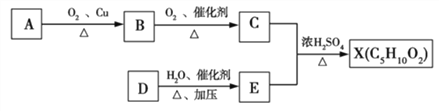
请根据以上信息,回答下列问题:
(1)A分子中官能团的名称是_____,E的结构简式是_______。
(2)D→E的化学反应类型为________。
(3)上述A、B、C、D、E、X六种物质中,互为同系物的是___。
(4)写出和E是同系物且差2个碳原子能和钠反应的所有同分异构体的结构简式_______________________________________________。
(5)反应C + E![]() X的化学方程式为____________________________。
X的化学方程式为____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com