
| A. | 3.0 mol | B. | 1.5mol | C. | 1.0mol | D. | 0.75mol |
分析 该反应中Pb元素化合价由+4价变为+2价、Cr元素化合价由+3价变为+6价,根据转移电子守恒计算PbO2的物质的量,以此解答该题.
解答 解:利用电子守恒,当1molCr3+被氧化为Cr2O72-(0.5mol)时,所失去的电子数为3mol,这些电子被PbO2得到,而1mol PbO2被还原只得到2mol电子,因此需要PbO2的物质的量为1.5mol,则与2molCr3+反应所需 PbO2 的物质的量为3.0mol.
故选A.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析、计算能力的考查,题目难度不大,注意根据化合价的变化结合氧化还原反应中氧化剂与还原剂得失电子数目相等进行计算.


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.7 mol/(L.min) | B. | v(B)=0.3mol/(L.min) | ||
| C. | v(C)=0.9 mol/(L.min) | D. | v(D)=1.1mol/(L.min) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| X | |||
| W |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
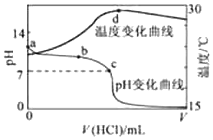 室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点由水电离出的c(H+)=1.0×10-14mol/L | |
| B. | b点:c(NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | b点时加入的盐酸体积小于20.00mL,而c点时加入的盐酸体积大于20.00mL | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在放电时,正极发生的反应是Pb(s)+SO42-(aq)-2e-═PbSO4(s) | |
| B. | 在放电时,该电池的负极材料是铅板 | |
| C. | 在充电时,电池中硫酸的浓度不断变小 | |
| D. | 在充电时,阳极发生的反应是PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com