


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源:不详 题型:填空题
 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O查看答案和解析>>
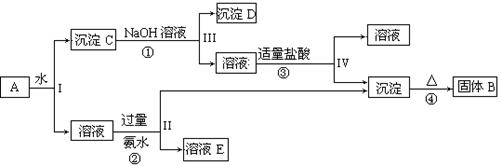
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
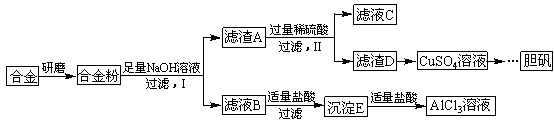
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
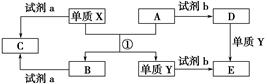
科目:高中化学 来源:不详 题型:单选题
| 第一份 | 加入0.5 g水 | 很快产生火花 |
| 第二份 | 加入1 g胆矾 | 约需30 s产生火花 |
| 第三份 | 加入1 g无水硫酸铜 | 1 min时仍没有明显反应现象 |
查看答案和解析>>
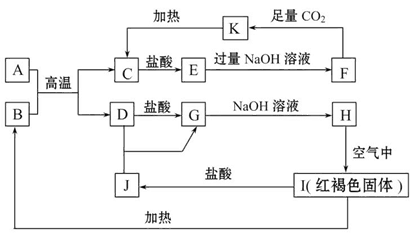
科目:高中化学 来源:不详 题型:填空题
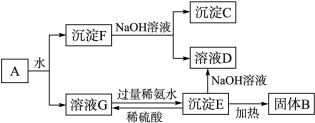
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
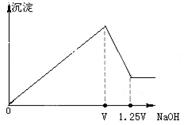
| A.1:1 | B.2:1 | C.3:2 | D.2:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
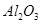 和冰晶石(
和冰晶石(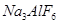 )混合熔融电解制得。
)混合熔融电解制得。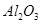 和
和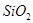 等。从铝土矿中提炼
等。从铝土矿中提炼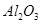 的流程如下:
的流程如下: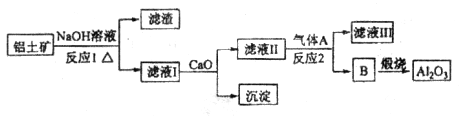
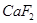 )和纯碱为原料制备冰晶石的流程如下:
)和纯碱为原料制备冰晶石的流程如下: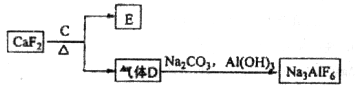
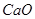 生成的沉淀是___________,反应2的离子方程式为____ ___________________
生成的沉淀是___________,反应2的离子方程式为____ ___________________查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com