
����Ŀ��Q��R��X��M��Y��Z��Ԫ�����ڱ�ǰ�����ڵ�����Ԫ�أ�ԭ���������ε�������֪��
��Zλ��ds���������ܲ�û�е����ӣ�����ľ�Ϊ����������Ԫ�أ�
��Yԭ�Ӽ۵����Ų�Ϊmsnmpn(m��n)��
��M�Ļ�̬ԭ��2p�ܼ���1�������ӣ�
��Q��Xԭ��p�����δ�ɶԵ���������2��
�û�ѧ����ش��������⣺
(1)Z�����ڱ��е�λ��______________��
(2)Q��R��X��M����Ԫ�ص�һ�������ɴ�С��˳��Ϊ__________ (�ö�ӦԪ�صķ�����д)��
(3)X��M��Ԫ���γɵĻ�����XM2��VSEPRģ������Ϊ_________����֪XM2���ӵļ��Ա�ˮ���ӵļ���������ԭ����__________________��
(4)�����±����������ʵļ�������(��λ��kJ/mol)��
A��B | A=B | A��B | |
QX | 357.7 | 798.9 | 1 071.9 |
R2 | 154.8 | 418.4 | 941.7 |
�ٽ������˵��QX��R2���õ�ԭ��________________________��
��QX��R2��Ϊ�ȵ����壬QX�ĽṹʽΪ(������λ����������ʾ)______��Fe����QX�γ�������ѧʽ��ѭ18���ӹ�������ԭ�ӵļ۵��������������ṩ�ĵ�����֮�͵���18���������ﻯѧʽΪ_______��
���𰸡��������ڵڢ�B�� F>N >O>C �������� OF2��H2O��ΪV�η���������ԭ�ӹµ��Ӷ�����Ϊ2��F��O�ĵ縺�Բ�ֵ��O��H�ĵ縺�Բ�ֵС CO�е�һ�����ѵ������ļ�����273 kJ/mol��N2�е�һ�����ѵ������ļ�����523.3 kJ/mol������CO�ĵ�һ������N2������ ![]() Fe(CO)5
Fe(CO)5
��������
����Zλ��ds���������ܲ�û�е����ӿ�֪��ZΪZnԪ�أ�
���ɳ�Z������ľ�Ϊ����������Ԫ�غ�Yԭ�Ӽ۵����Ų�Ϊmsnmpn(m��n)��֪��YΪSiԪ�أ�
����M�Ļ�̬ԭ��2p�ܼ���1�������ӿ�֪��MΪFԪ�أ�
����Q��R��X��M��Y��Zԭ���������ε�����Q��Xԭ��p�����δ�ɶԵ���������2��֪��QΪCԪ�ء�RΪNԪ�ء�XΪOԪ�ء�
(1) ZΪZnԪ�أ�ԭ������Ϊ28��λ�����ڱ�����������B�壬�ʴ�Ϊ������������B�壻
��2��ͬ����Ԫ�أ������ҵ�һ�����ܳ���������ƣ�����A��Ԫ�ص�ԭ��p������ڰ����״̬����һ�����ܱ�����Ԫ�ش���C��N��O��F����Ԫ�ص�һ�������ɴ�С��˳��ΪF>N >O>C���ʴ�Ϊ��F>N >O>C��
��3��OF2��������ԭ�ӵļ۲���Ӷ���Ϊ4���¶Ե�����Ϊ2����OF2���ӵ�VSEPRģ��Ϊ�������Σ��ռ乹��ΪV�Σ�OF2��H2O��ΪV�η���������ԭ�ӹµ��Ӷ�����Ϊ2��F��O�ĵ縺�Բ�ֵ��O��H�ĵ縺�Բ�ֵС����OF2���ӵļ��Ա�ˮ���ӵļ��������ʴ�Ϊ���������Σ�OF2��H2O��ΪV�η���������ԭ�ӹµ��Ӷ�����Ϊ2��F��O�ĵ縺�Բ�ֵ��O��H�ĵ縺�Բ�ֵС��
��4�������ݱ������ݿ�֪������C��O�е�һ���м����ĵ�������1071.9kJ/mol-798.9kJ/mol=273kJ/mol������N��N�е�һ���м����ĵ�������941.7kJ/mol-418.4kJ/mol=523.3kJ/mol������һ���м�CO��N2�����ף���CO�����ã��ʴ�Ϊ��CO�е�һ�����ѵ������ļ�����273 kJ/mol��N2�е�һ�����ѵ������ļ�����523.3 kJ/mol������CO�ĵ�һ������N2�����ϣ�
���ȵ����������ͬ�Ľṹ����N2���ӵĽṹN��N��֪��CO�����а���1���Ҽ�����λ������2���м�����ṹʽΪ![]() ��������ԭ�ӵļ۵��������������ṩ�ĵ�����֮�͵���18��֪��Fe��CO�γɵ�����ﻯѧʽΪFe(CO)5���ʴ�Ϊ��
��������ԭ�ӵļ۵��������������ṩ�ĵ�����֮�͵���18��֪��Fe��CO�γɵ�����ﻯѧʽΪFe(CO)5���ʴ�Ϊ��![]() ��Fe(CO)5��
��Fe(CO)5��


 ����5��2���ϵ�д�
����5��2���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ,��1.0L c mol��L-1 CH3COOH��Һ��0.1mol NaOH�����ϣ�ʹ֮��ַ�Ӧ��Ȼ����û����Һ��ͨ��HCl��������NaOH����(����������¶ȱ仯)����ҺpH��ͨ��(�����)���ʵ����ʵ����ı仯��ͼ��ʾ�����������������( )
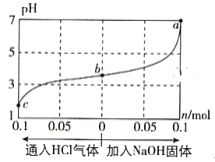
A. ˮ�ĵ���̶ȣ�a>b>c
B. c���Ӧ�Ļ����Һ�У�c(CH3COOH)>c(Na+)>c(OH-)
C. a���Ӧ�Ļ����Һ�У�c(Na+)=c(CH3COO-)
D. ���¶��£�CH3COOH�ĵ���ƽ�ⳣ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮϵ�����ӵ�ذ�ȫ���ܺá��۸�������Ի����Ѻã����ž���г�ǰ����ij�����ӵ�ع���ԭ����ͼ������ܷ�ӦΪ��2NaFePO4F + Na3Ti2(PO4)3![]() 2Na2FePO4F+ NaTi2(PO4)3
2Na2FePO4F+ NaTi2(PO4)3
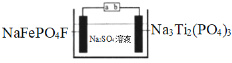
����˵���������
A.���ʱ��a�ӵ�Դ����
B.�ŵ�ʱ����Һ�е�Na+��NaFePO4F�缫�ϵõ��ӱ���ԭ
C.���ʱ�������ϵĵ缫��ӦΪNaTi2(PO4)3+2Na++2e��=Na3Ti2(PO4)3
D.�����ϣ��õ���ڳ���ŵ��������Һ�е�c(Na+)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ��![]() ��
��![]() Ϊһ�ֿɳ���ص�ʾ��ͼ�����е����ӽ���Ĥֻ����K+ͨ�����õ�ع����Ļ�ѧ����ʽΪ��
Ϊһ�ֿɳ���ص�ʾ��ͼ�����е����ӽ���Ĥֻ����K+ͨ�����õ�ع����Ļ�ѧ����ʽΪ��![]() ��װ��
��װ��![]() ��
��![]() Ϊ���ص�ʾ��ͼ�����պϿ���Kʱ���缫X������Һ�ȱ����պ�Kʱ������˵����ȷ���ǣ� ��
Ϊ���ص�ʾ��ͼ�����պϿ���Kʱ���缫X������Һ�ȱ����պ�Kʱ������˵����ȷ���ǣ� ��
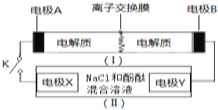
A.�缫A�Ϸ����ĵ缫��ӦʽΪ��![]()
B.K+���ҵ���ͨ�����ӽ���Ĥ
C.�缫X�Ϸ����ĵ缫��ӦʽΪ��![]()
D.����0.1 mol ![]() ͨ�����ӽ���Ĥʱ��Y�缫�ϲ���2.24L(��״��)����
ͨ�����ӽ���Ĥʱ��Y�缫�ϲ���2.24L(��״��)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ�ζ�ͬ�к͵ζ�����(����֪Ũ�ȵ���������Һ�ζ�δ֪Ũ�ȵĻ�ԭ����Һ��֮)������0.0010 mol��L1����KMnO4��Һ�ζ�δ֪Ũ�ȵ���ɫNaHSO3��Һ����Ӧ�����ӷ���ʽΪ2![]() ��5
��5![]() ��H��=2Mn2+��5
��H��=2Mn2+��5![]() ��3H2O��������������⣺
��3H2O��������������⣺
(1)��ʵ����˵ζ���(50 mL)������̨���ζ��ܼС��ձ� ����ֽ����������Ʒ�⣬������ʹ�õ�������____________��
(2)ʵ������_____(����������������)ʽ�ζ���ʢװ����KMnO4��Һ��ԭ����_______��
(3)��ʵ��_______(������Ҫ����������Ҫ��)ʹ��ָʾ�����ζ��յ��������__________��
(4)�ٵζ�ǰƽ��Һ�棬�̶�Ϊa mL���ζ����ӿ̶�Ϊb mL������(ba) mL����õ��Ĵ���ҺŨ�ȱ�ʵ��Ũ��_____(����������������)��
�����ζ�ʱ���õ�����KMnO4��Һ����ö�����Ũ�ȱ�С�����ɴ˲�õĴ���ҺŨ��ֵ��____(����ƫС����ƫ��������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ���ƽ�����װ��ǿ��ԭ���£�N2H4����ǿ��������H2O2���������ǻ��ʱ������������![]() N2��ˮ���������ų������ȣ���֪0.4molҺ̬�º�����Һ̬H2O2��Ӧ�����ɵ�����ˮ�������ų�256kJ��������
N2��ˮ���������ų������ȣ���֪0.4molҺ̬�º�����Һ̬H2O2��Ӧ�����ɵ�����ˮ�������ų�256kJ��������
��1��д���÷�Ӧ���Ȼ�ѧ����ʽ________________��
��2����֪H2O��l���TH2O��g������H=+44kJ��mol1����16gҺ̬��ȼ�����ɵ�����Һ̬ˮʱ���ų���������________kJ��
��3������ȼ�տ���ͨ����������;����
;��I��C3H8��g��+5O2��g���T3CO2��g��+4H2O��l����H=a kJ��mol1
;��II��C3H8��g���TC3H6��g��+H2��g����H=+b kJ��mol1
2C3H6��g��+9O2��g���T6CO2��g��+6H2O��l����H=c kJ��mol1
2H2��g��+O2 ��g���T2H2O��l����H=d kJ��mol1 ��abcd��Ϊ��ֵ��
���жϵ����ı���ͨ������;���ų���������;��I�ų�������_______��������������������������С������;��II�ų���������
����C3H8��g���TC3H6��g��+H2��g�� �ķ�Ӧ�У���Ӧ����е�������________��������������������������С��������������е���������
��b ��a��c��d����ѧ��ϵʽ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����������������IJ��輰��ӦΪ��
�������� ��
��
�ڴ�������![]() ��
��
�����գ�![]() ��
��
(1)����ͼ1д��![]() ��
��![]() ��Ӧ����
��Ӧ����![]() ���Ȼ�ѧ����ʽ�� ______ ��
���Ȼ�ѧ����ʽ�� ______ ��

(2)ij�¶���![]() ��
��![]() ����ʼʱ��10L���ܱ������м���
����ʼʱ��10L���ܱ������м���![]() ��
��![]() ������Ӧ�ﵽƽ��ʱ���ų�����196kJ������¶���
������Ӧ�ﵽƽ��ʱ���ų�����196kJ������¶���![]() ƽ�ⳣ��K=______ ��
ƽ�ⳣ��K=______ ��
(3)ij��������ͼ2��ʾװ���õ绯ѧԭ���������ᣬд��ͨ��![]() �ĵ缫�ĵ缫��Ӧʽ�� ______ ��
�ĵ缫�ĵ缫��Ӧʽ�� ______ ��
(4)����ֻ�ܱ�����A��B��A������һ�ƶ��Ļ�����ʹ�����ڱ��ֺ�ѹ��B�����ܱ��ֺ��ݣ���ʼ������ֻ�����зֱ��������������Ϊ2��1��![]() ��
��![]() �Ļ�����壬��ʹA��B�ݻ����
�Ļ�����壬��ʹA��B�ݻ����![]() ��ͼ
��ͼ![]() ��
��![]() ʱ�������·�Ӧ��
ʱ�������·�Ӧ��![]() ��д���пո�
��д���пո�
��![]() ������
������![]() ��ת���ʱ�B���� ______
��ת���ʱ�B���� ______
�ڴﵽ![]() ����ƽ�������������ͨ�������ԭ��Ӧ���壬�ﵽƽ��ʱA������
����ƽ�������������ͨ�������ԭ��Ӧ���壬�ﵽƽ��ʱA������![]() ��������� ______
��������� ______ ![]() ����������
����������![]() ��B������
��B������![]() ��������� ______
��������� ______ ![]() ����������
����������![]()
(5)���ڷ�Ӧ![]() ��һ�������´ﵽƽ����ڱ�֤O2Ũ�Ȳ��������£�����������������Ը���ƽ�ⳣ�����ж�ƽ�� ______
��һ�������´ﵽƽ����ڱ�֤O2Ũ�Ȳ��������£�����������������Ը���ƽ�ⳣ�����ж�ƽ�� ______ ![]() ���������ƶ������������ƶ����������ƶ���
���������ƶ������������ƶ����������ƶ���![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��л��������������ȷ����(����)
A. CH2===CH��CH===CH21��3������ϩ
B.  3������
3������
C.  ������
������
D.  2��������
2��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com