
【题目】如图装置![]() Ⅰ
Ⅰ![]() 为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池工作的化学方程式为:
为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池工作的化学方程式为:![]() ,装置
,装置![]() Ⅱ
Ⅱ![]() 为电解池的示意图。当闭合开关K时,电极X附近溶液先变红则闭合K时,下列说法正确的是( )
为电解池的示意图。当闭合开关K时,电极X附近溶液先变红则闭合K时,下列说法正确的是( )
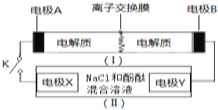
A.电极A上发生的电极反应式为:![]()
B.K+从右到左通过离子交换膜
C.电极X上发生的电极反应式为:![]()
D.当有0.1 mol ![]() 通过离子交换膜时,Y电极上产生2.24L(标准状况)气体
通过离子交换膜时,Y电极上产生2.24L(标准状况)气体
科目:高中化学 来源: 题型:
【题目】25℃时,二元弱酸H2R的pKa1=1.85,pKa2=7.45(已知pKa=-lgKa)。在此温度下向20mL0.1molL-1H2R溶液中滴加0.1molL-1的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。

下列有关说法正确的是( )
A. a点所示溶液中:c(H2R)+c(HR-)+c(R2-)=0.1molL-1
B. b点所示溶液中:c(Na+)>c(HR-)>c(H2R)>c(R2-)
C. c点溶液中水电离程度大于d点溶液
D. d点所示溶液中:c(Na+)>c(R2-)>c(HR-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C1O2作为一种强氧化剂,是国际上公认的高效消毒灭菌剂,但因其易爆有毒,常用NaClO2替代。常温下,将NaOH固体加入到由0.1molC1O2溶于水配成的1L溶液中。溶液pH及部分组分含量变化曲线如图,下列叙述不正确的是

(已知:2C1O2+H2O![]() HC1O2+H++C1O3-)
HC1O2+H++C1O3-)
A. Ka(HClO2)≈10-4.5
B. 不能用pH试纸测该溶液的pH
C. 酸性:HClO2<HClO3,氧化性:HClO2>HClO3
D. 该图像上任何一点,都有c(C1O2-)+c(HC1O2)+c(C1O3-)=0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下图所示的四个原电池装置,其中结论正确的是
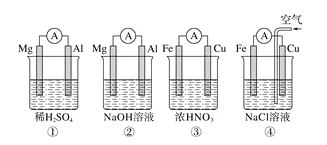
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为![]()
C.③中Fe作负极,电极反应式为![]()
D.④中Cu作正极,电极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均釆用虚线表示。
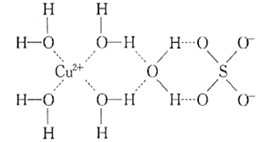
(1)写出与Cu在同一周期且未成对电子数最多的基态原子的电子排布式:______ ,S原子的价层电子排布图______________。
(2)写出胆矾晶体中水合铜离子的结构简式______________(必须将配位键表示出来)。
(3)向胆矾溶液中滴加氨水至过量,最终得到深蓝色的透明溶液,再加入乙醇后析出深蓝色晶体,写出生成深蓝色透明溶液的离子方程式__________。比较NH3和[Cu(NH3)4]2+中H-N-H 中键角的大小:NH3______[Cu(NH3)4]2+(填“>” “<” 或“=”)。
(4)已知H2O2的结构如图:
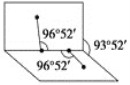
H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′,估计它难溶于CS2,简要说明原因__________________________。
(5)Co3+形成的化合物[Co(NH3)5N3]SO4中Co的配位数为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
已知:N2H4·H2O高温易分解,易氧化
制备原理:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
(实验一) 制备NaClO溶液(实验装置如图所示)

(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有_____(填标号)
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应化学程式是_____________________________。
(实验二) 制取水合肼。(实验装置如图所示)
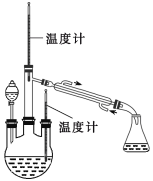
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114馏分。
(3)分液漏斗中的溶液是____________(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO混合溶液
选择的理由是____________。蒸馏时需要减压,原因是______________。
(实验三) 测定馏分中肼含量。
(4)水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体(保证滴定过程中溶液的pH保持在6.5左右),配制1000mL溶液。
b.移取10.00 mL于锥形瓶中,加入10mL水,摇匀。
c.用0.2000mol/L碘溶液滴定至溶液出现______________,记录消耗碘的标准液的体积。
d.进一步操作与数据处理
(5)滴定时,碘的标准溶液盛放在______________滴定管中(选填:“酸式”或“碱式”)水合肼与碘溶液反应的化学方程式________________________。
(6)若本次滴定消耗碘的标准溶液为8.20mL,馏分中水合肼(N2H4·H2O)的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、M、Y、Z是元素周期表前四周期的六种元素,原子序数依次递增。已知:
①Z位于ds区,最外能层没有单电子,其余的均为短周期主族元素;
②Y原子价电子排布为msnmpn(m≠n);
③M的基态原子2p能级有1个单电子;
④Q、X原子p轨道的未成对电子数都是2。
用化学术语回答下列问题:
(1)Z在周期表中的位置______________。
(2)Q、R、X、M四种元素第一电离能由大到小的顺序为__________ (用对应元素的符号填写)。
(3)X、M两元素形成的化合物XM2的VSEPR模型名称为_________,已知XM2分子的极性比水分子的极性弱,其原因是__________________。
(4)分析下表中两种物质的键能数据(单位:kJ/mol)。
A—B | A=B | A≡B | |
QX | 357.7 | 798.9 | 1 071.9 |
R2 | 154.8 | 418.4 | 941.7 |
①结合数据说明QX比R2活泼的原因:________________________。
②QX与R2互为等电子体,QX的结构式为(若有配位键请用→表示)______。Fe易与QX形成配合物,化学式遵循18电子规则:中心原子的价电子数加上配体提供的电子数之和等于18,则此配合物化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,要满足下列要求:①工作一段时间后A槽pH值上升,B槽的pH下降。②b、c两极上反应的离子的物质的量相等。应选择的电解质是( )

A.A槽NaOH溶液;B槽CuSO4溶液
B.A槽AgNO3溶液;B槽CuCl2溶液
C.A槽Na2SO4溶液;B槽AgNO3溶液
D.A槽NaCl溶液;B槽AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修3:物质结构与性质】铜元素可形成多种重要化合物。回答下列问题:
(1)铜元素位于元素周期表中的_____区,其基态原子的价电子排布图为_________。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是__________。
②在[Cu(NH3)4]SO4中,Cu2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_________。
③除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为________。
④NF3与NH3的空间构型相同,中心原子的轨道杂化类型均为_________。但NF3不易与Cu2+形成化学键,其原因是_______________。
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。

①该物质的化学式为__________。
②已知该晶胞中两个Ba2+的间距为cpm.则距离Ba2+最近的Hg+数目为_____个,二者的最短距离为_______pm。(列出计算式即可,下同)
③设该物质的摩尔质量为M,阿伏加德罗常数的值为NA,则该晶体的密度为______g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com