
【题目】分析下图所示的四个原电池装置,其中结论正确的是
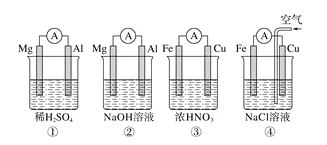
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为![]()
C.③中Fe作负极,电极反应式为![]()
D.④中Cu作正极,电极反应式为![]()
科目:高中化学 来源: 题型:
【题目】实验室模拟合成![]() 和CH3CH2CH2Br的方法如图1。
和CH3CH2CH2Br的方法如图1。
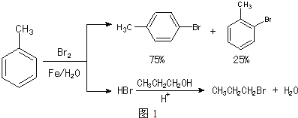
已知:甲苯和液溴在有少量水存在时也能反应(如图2):

实验室模拟合成对溴甲苯和1-溴丙烷的流程和相关数据如表:
物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | 对溴甲苯 | 邻溴甲苯 |
沸点(℃) | 110.8 | 97.2 | 71 | 184.3 | 181.7 |
(1)实验室存放液溴的试剂瓶需密闭,同时瓶中要加入____,以减少溴的挥发.写出甲苯和液溴反应生成对溴甲苯的化学方程式___。
(2)反应装置如图3所示:
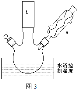
①图中玻璃仪器a的名称是____,方块b中为某玻璃仪器,其名称是___。
②三颈烧瓶中开始加入了甲苯、铁粉和水。加入的适量水的作用是:易于控制温度和____,加热搅拌操作中加入浓硫酸,完成1-丙醇的取代反应,浓硫酸的作用是____。
(3)操作I的名称是___,操作Ⅲ的名称是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观的描述化学反应的进程或结果。下列图像描述正确的是:
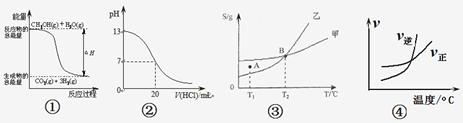
A.根据图①可判断反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的ΔH<0
B.图②表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液的pH随加入酸体积的变化
C.根据图③(S表示溶解度),A点表示T1℃时甲为饱和溶液,乙溶液未饱和。
D.根据图④可判断可逆反应A2(g)+3B2(g)![]() 2AB3(g)的ΔH>0
2AB3(g)的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01 mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解)。下列叙述正确的是( )
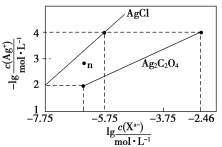
A.Ksp(Ag2C2O4)的数量级等于10-11
B.n点表示AgCl的不饱和溶液
C.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4+2Cl-=2AgCl+C2O42-的平衡常数为109.04
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水系钠离子电池安全性能好、价格低廉、对环境友好,有着巨大的市场前景。某钠离子电池工作原理如图,电池总反应为:2NaFePO4F + Na3Ti2(PO4)3![]() 2Na2FePO4F+ NaTi2(PO4)3
2Na2FePO4F+ NaTi2(PO4)3
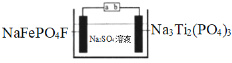
下列说法错误的是
A.充电时,a接电源正极
B.放电时,溶液中的Na+在NaFePO4F电极上得电子被还原
C.充电时,阴极上的电极反应为NaTi2(PO4)3+2Na++2e﹣=Na3Ti2(PO4)3
D.理论上,该电池在充电或放电过程中溶液中的c(Na+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置图 |
|
|
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | B中产生白色沉淀,C中溶液颜色褪去 | 试管中液体变浑浊 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | 硫酸亚铁铵分解的产物中除NH3外还含有SO3 和SO2 | 非金属性:C>Si |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置![]() Ⅰ
Ⅰ![]() 为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池工作的化学方程式为:
为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池工作的化学方程式为:![]() ,装置
,装置![]() Ⅱ
Ⅱ![]() 为电解池的示意图。当闭合开关K时,电极X附近溶液先变红则闭合K时,下列说法正确的是( )
为电解池的示意图。当闭合开关K时,电极X附近溶液先变红则闭合K时,下列说法正确的是( )
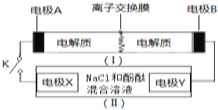
A.电极A上发生的电极反应式为:![]()
B.K+从右到左通过离子交换膜
C.电极X上发生的电极反应式为:![]()
D.当有0.1 mol ![]() 通过离子交换膜时,Y电极上产生2.24L(标准状况)气体
通过离子交换膜时,Y电极上产生2.24L(标准状况)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量![]() N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量。
N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量。
(1)写出该反应的热化学方程式________________。
(2)已知H2O(l)═H2O(g);△H=+44kJ·mol1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=a kJ·mol1
途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol1
2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=c kJ·mol1
2H2(g)+O2 (g)═2H2O(l)△H=d kJ·mol1 (abcd均为正值)
①判断等量的丙烷通过两种途径放出的热量,途径I放出的热量_______(填“大于”、“等于”或“小于”)途径II放出的热量。
②在C3H8(g)═C3H6(g)+H2(g) 的反应中,反应物具有的总能量________(填“大于”、“等于”或“小于”)生成物具有的总能量。
③b 与a、c、d的数学关系式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1 KOH溶液滴定 10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。下列说法正确的是
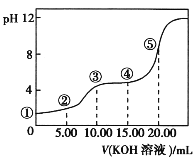
A.点①所示溶液中:![]() =1012
=1012
B.点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
C.点③所示溶液中:c(K+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-)
D.点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com