
����Ŀ��1915��ŵ��������ѧ������Henry Bragg��Lawrence Bragg���Ա���������X���߶Ծ���ṹ�ķ��������Ĺ��ס���ѧ��ͨ��X�����Ʋ���мȺ�����λ�����ֺ����������ṹʾ��ͼ�ɼ�ʾ��ͼ��������λ���������������߱�ʾ��
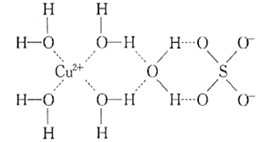
(1)д����Cu��ͬһ������δ�ɶԵ��������Ļ�̬ԭ�ӵĵ����Ų�ʽ��______ ��Sԭ�ӵļ۲�����Ų�ͼ______________��
(2)д������������ˮ��ͭ���ӵĽṹ��ʽ______________(���뽫��λ����ʾ����)��
(3)����Һ�еμӰ�ˮ�����������յõ�����ɫ������Һ���ټ����Ҵ�����������ɫ���壬д����������ɫ����Һ�����ӷ���ʽ__________���Ƚ�NH3��[Cu(NH3)4]2+��H-N-H �м��ǵĴ�С��NH3______[Cu(NH3)4]2+(�������� ������ ����=��)��
(4)��֪H2O2�Ľṹ��ͼ��
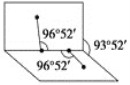
H2O2���Ӳ���ֱ���εģ�����Hԭ�������ڰ�չ�����������ֽ�ϣ���ҳ��Ϊ93��52����������O��H����O��O���ļнǾ�Ϊ96��52����������������CS2����Ҫ˵��ԭ��__________________________��
(5)Co3+�γɵĻ�����[Co(NH3)5N3]SO4��Co����λ��Ϊ_____��
���𰸡�1s22s22p63s23p63d54s1��[Ar]3d54s1 ![]()
 Cu(OH)2+4NH3 ��H2O��[Cu(NH3)4]2++2OH-+4H2O < ��H2O2Ϊ���Է��ӣ���CS2Ϊ�Ǽ����ܼ��������������ܹ��ɣ�H2O2������CS2�� 6
Cu(OH)2+4NH3 ��H2O��[Cu(NH3)4]2++2OH-+4H2O < ��H2O2Ϊ���Է��ӣ���CS2Ϊ�Ǽ����ܼ��������������ܹ��ɣ�H2O2������CS2�� 6
��������
��1��Cu��ԭ������Ϊ29�������Ų�ʽΪ1s22s22p63s23p63d104s1��[Ar]3d104s1��S��ԭ������Ϊ16�������Ų�ʽΪ1s22s22p63s23p3��
��2������������ͭ���Ӻ��пչ����ˮ���Ӻ��й¶Ե��Ӷԣ�ͭ������ˮ����֮���γ���λ����
��3������Һ�еμӰ�ˮ������ͭ�백ˮ��Ӧ����ǿ����ͭ������������ͭ�������ڹ����İ�ˮ���ɺ�������ɫͭ�������ӵ�����Һ����ΪNH3�ṩ�¶Ե�����Cu2+�γ���λ����N-H�ɼ����Ӷ��ܵ����ų�����С������H-N-H��������
��4����������ԭ����ָ���ڼ��Է��Ӽ�ĵ������ã�ʹ�ü��Է�����ɵ����������ڼ��Է�����ɵ��ܼ��������ڷǼ��Է�����ɵ��ܼ����Ǽ��Է�����ɵ����������ڷǼ��Է�����ɵ��ܼ��������ڼ��Է�����ɵ��ܼ���
��5���ɻ�����Ļ�ѧʽΪ[Co(NH3)5N3]SO4��֪�����������Ϊ��������磬[Co(NH3)5N3]2+Ϊ�ڽ磬�ڽ���Co3+Ϊ�������ӣ�NH3��N3��Ϊ���塣
��1��Cu��ԭ������Ϊ29�������Ų�ʽΪ1s22s22p63s23p63d104s1��[Ar]3d104s1��S��ԭ������Ϊ16�������Ų�ʽΪ1s22s22p63s23p3���۲�����Ų�ͼΪ![]() ���ʴ�Ϊ��1s22s22p63s23p63d54s1��[Ar]3d54s1��
���ʴ�Ϊ��1s22s22p63s23p63d54s1��[Ar]3d54s1��![]() ��
��
��2������������ͭ���Ӻ��пչ����ˮ���Ӻ��й¶Ե��Ӷԣ�ͭ������ˮ����֮���γ���λ����ͭ����������Ϊ4��ˮ��ͭ���ӵĽṹ��ʽΪ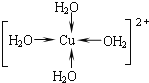 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��3������Һ�еμӰ�ˮ������ͭ�백ˮ��Ӧ����ǿ����ͭ������������ͭ�������ڹ����İ�ˮ���ɺ�������ɫͭ�������ӵ�����Һ����Ӧ�����ӷ���ʽΪ��Cu��OH��2+4NH3H2O=[Cu��NH3��4]2++2OH-+4H2O����ΪNH3�ṩ�¶Ե�����Cu2+�γ���λ����N-H�ɼ����Ӷ��ܵ����ų�����С������H-N-H�������ʴ�Ϊ��Cu��OH��2+4NH3H2O=[Cu��NH3��4]2++2OH-+4H2O��<��
��4����������ԭ����ָ���ڼ��Է��Ӽ�ĵ������ã�ʹ�ü��Է�����ɵ����������ڼ��Է�����ɵ��ܼ��������ڷǼ��Է�����ɵ��ܼ����Ǽ��Է�����ɵ����������ڷǼ��Է�����ɵ��ܼ��������ڼ��Է�����ɵ��ܼ�����ͼ��֪˫��ˮ��һ�ֺ����������ۼ�������ۼ��ļ��Է��ӣ�CS2�ǷǼ��Է��ӣ������������ܵ�ԭ����֪��H2O2������CS2���ʴ�Ϊ����H2O2Ϊ���Է��ӣ���CS2Ϊ�Ǽ����ܼ��������������ܹ��ɣ�H2O2������CS2�У�
��5���ɻ�����Ļ�ѧʽΪ[Co(NH3)5N3]SO4��֪�����������Ϊ��������磬[Co(NH3)5N3]2+Ϊ�ڽ磬�ڽ���Co3+Ϊ�������ӣ�NH3��N3��Ϊ���壬��λ��Ϊ6���ʴ�Ϊ��6��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����±���ʾΪԪ�����ڱ���һ���֣�����Ԫ�آ١����ڱ��е�λ�ã���ش��������⣺
�� ���� | IA | 0 | ||||||
1 | �� | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | �� | �� | ||||||
3 | �� | �� | �� | �� | ||||
��1���ۢܢߵ�ԭ�Ӱ뾶�ɴ�С��˳��Ϊ____����Ԫ�ط��ű�ʾ����
��2���͢ߵ���ۺ����������ǿ��Ϊ____������Ļ�ѧʽ��ʾ����
��3���ڢ�����Ԫ�ذ�ԭ�Ӹ���֮��Ϊ1��1��ɵĻ�����ĵ���ʽ____��
��4���٢�����Ԫ�ذ�ԭ�Ӹ���֮��Ϊ1��1��ɵij���Һ̬�������������Һ���ܽ�Fe2+������д���÷�Ӧ�����ӷ���ʽ___��
��5�����Тݵĵ��ʺܵ͢����������ˮ���ﷴӦ�Ļ�ѧ����ʽΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ���о�ˮ���ã�����ʴ�豸�����ۺ��Ȼ�����һ�����͵���������������ˮ��
���о�ˮ���ã�����ʴ�豸�����ۺ��Ȼ�����һ�����͵���������������ˮ��![]() ��Ч���Ҹ�ʴ��С����ش��������⣺
��Ч���Ҹ�ʴ��С����ش��������⣺
(1)![]() ��ˮ��ԭ����________________________________________��
��ˮ��ԭ����________________________________________��![]() ��Һ��ʴ�����豸����
��Һ��ʴ�����豸����![]() �����⣬��һ��Ҫԭ����(�����ӷ���ʽ��ʾ)__________________________________��
�����⣬��һ��Ҫԭ����(�����ӷ���ʽ��ʾ)__________________________________��
(2)![]() ����Һ�з�����ˮ�⣺
����Һ�з�����ˮ�⣺
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
����ˮ�ⷴӦ��ƽ�ⳣ��![]() �ɴ�С��˳����___________________________________________________________��
�ɴ�С��˳����___________________________________________________________��
(3)ͨ����������������ˮ�����ۺϣ����ɾۺ��Ȼ��������ӷ���ʽΪ��![]()
![]()
![]()
��ʹƽ�������ƶ��ɲ��õķ�����(�����)________��
a.���� b.��ˮϡ��
c.����![]() d.����
d.����![]()
�����£�ʹ�Ȼ�����Һת��Ϊ��Ũ�Ⱦۺ��Ȼ����Ĺؼ�������____________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮϵ�����ӵ�ذ�ȫ���ܺá��۸�������Ի����Ѻã����ž���г�ǰ����ij�����ӵ�ع���ԭ����ͼ������ܷ�ӦΪ��2NaFePO4F + Na3Ti2(PO4)3![]() 2Na2FePO4F+ NaTi2(PO4)3
2Na2FePO4F+ NaTi2(PO4)3
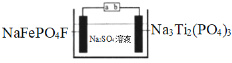
����˵���������
A.���ʱ��a�ӵ�Դ����
B.�ŵ�ʱ����Һ�е�Na+��NaFePO4F�缫�ϵõ��ӱ���ԭ
C.���ʱ�������ϵĵ缫��ӦΪNaTi2(PO4)3+2Na++2e��=Na3Ti2(PO4)3
D.�����ϣ��õ���ڳ���ŵ��������Һ�е�c(Na+)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�������Ӧ����M(s)+N(g) ![]() R(g) ��H=��Q1 kJ/mol����2R(g)+N(g)
R(g) ��H=��Q1 kJ/mol����2R(g)+N(g) ![]() 2T(g) ��H=��Q2 kJ/mol��Q1��Q2��Q3��Ϊ��ֵ������˵����ȷ���� ���� ����
2T(g) ��H=��Q2 kJ/mol��Q1��Q2��Q3��Ϊ��ֵ������˵����ȷ���� ���� ����
A.1mol R(g)�������ܺʹ���1mol M(s)��1mol N(g)�������ܺ�
B.��2mol R(g)��1mol N(g)�ڸ������·�Ӧ�����Էų�����Q2 kJ
C.��1mol M(s)��ȫת��ΪT(g)ʱ���ٶ���������ʧ�����ų�����![]()
D.M(g)+N(g) ![]() R(g) ��H=��Q3 kJ/mol����Q3 ��Q1
R(g) ��H=��Q3 kJ/mol����Q3 ��Q1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ��![]() ��
��![]() Ϊһ�ֿɳ���ص�ʾ��ͼ�����е����ӽ���Ĥֻ����K+ͨ�����õ�ع����Ļ�ѧ����ʽΪ��
Ϊһ�ֿɳ���ص�ʾ��ͼ�����е����ӽ���Ĥֻ����K+ͨ�����õ�ع����Ļ�ѧ����ʽΪ��![]() ��װ��
��װ��![]() ��
��![]() Ϊ���ص�ʾ��ͼ�����պϿ���Kʱ���缫X������Һ�ȱ����պ�Kʱ������˵����ȷ���ǣ� ��
Ϊ���ص�ʾ��ͼ�����պϿ���Kʱ���缫X������Һ�ȱ����պ�Kʱ������˵����ȷ���ǣ� ��
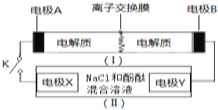
A.�缫A�Ϸ����ĵ缫��ӦʽΪ��![]()
B.K+���ҵ���ͨ�����ӽ���Ĥ
C.�缫X�Ϸ����ĵ缫��ӦʽΪ��![]()
D.����0.1 mol ![]() ͨ�����ӽ���Ĥʱ��Y�缫�ϲ���2.24L(��״��)����
ͨ�����ӽ���Ĥʱ��Y�缫�ϲ���2.24L(��״��)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ�ζ�ͬ�к͵ζ�����(����֪Ũ�ȵ���������Һ�ζ�δ֪Ũ�ȵĻ�ԭ����Һ��֮)������0.0010 mol��L1����KMnO4��Һ�ζ�δ֪Ũ�ȵ���ɫNaHSO3��Һ����Ӧ�����ӷ���ʽΪ2![]() ��5
��5![]() ��H��=2Mn2+��5
��H��=2Mn2+��5![]() ��3H2O��������������⣺
��3H2O��������������⣺
(1)��ʵ����˵ζ���(50 mL)������̨���ζ��ܼС��ձ� ����ֽ����������Ʒ�⣬������ʹ�õ�������____________��
(2)ʵ������_____(����������������)ʽ�ζ���ʢװ����KMnO4��Һ��ԭ����_______��
(3)��ʵ��_______(������Ҫ����������Ҫ��)ʹ��ָʾ�����ζ��յ��������__________��
(4)�ٵζ�ǰƽ��Һ�棬�̶�Ϊa mL���ζ����ӿ̶�Ϊb mL������(ba) mL����õ��Ĵ���ҺŨ�ȱ�ʵ��Ũ��_____(����������������)��
�����ζ�ʱ���õ�����KMnO4��Һ����ö�����Ũ�ȱ�С�����ɴ˲�õĴ���ҺŨ��ֵ��____(����ƫС����ƫ��������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����������������IJ��輰��ӦΪ��
�������� ��
��
�ڴ�������![]() ��
��
�����գ�![]() ��
��
(1)����ͼ1д��![]() ��
��![]() ��Ӧ����
��Ӧ����![]() ���Ȼ�ѧ����ʽ�� ______ ��
���Ȼ�ѧ����ʽ�� ______ ��

(2)ij�¶���![]() ��
��![]() ����ʼʱ��10L���ܱ������м���
����ʼʱ��10L���ܱ������м���![]() ��
��![]() ������Ӧ�ﵽƽ��ʱ���ų�����196kJ������¶���
������Ӧ�ﵽƽ��ʱ���ų�����196kJ������¶���![]() ƽ�ⳣ��K=______ ��
ƽ�ⳣ��K=______ ��
(3)ij��������ͼ2��ʾװ���õ绯ѧԭ���������ᣬд��ͨ��![]() �ĵ缫�ĵ缫��Ӧʽ�� ______ ��
�ĵ缫�ĵ缫��Ӧʽ�� ______ ��
(4)����ֻ�ܱ�����A��B��A������һ�ƶ��Ļ�����ʹ�����ڱ��ֺ�ѹ��B�����ܱ��ֺ��ݣ���ʼ������ֻ�����зֱ��������������Ϊ2��1��![]() ��
��![]() �Ļ�����壬��ʹA��B�ݻ����
�Ļ�����壬��ʹA��B�ݻ����![]() ��ͼ
��ͼ![]() ��
��![]() ʱ�������·�Ӧ��
ʱ�������·�Ӧ��![]() ��д���пո�
��д���пո�
��![]() ������
������![]() ��ת���ʱ�B���� ______
��ת���ʱ�B���� ______
�ڴﵽ![]() ����ƽ�������������ͨ�������ԭ��Ӧ���壬�ﵽƽ��ʱA������
����ƽ�������������ͨ�������ԭ��Ӧ���壬�ﵽƽ��ʱA������![]() ��������� ______
��������� ______ ![]() ����������
����������![]() ��B������
��B������![]() ��������� ______
��������� ______ ![]() ����������
����������![]()
(5)���ڷ�Ӧ![]() ��һ�������´ﵽƽ����ڱ�֤O2Ũ�Ȳ��������£�����������������Ը���ƽ�ⳣ�����ж�ƽ�� ______
��һ�������´ﵽƽ����ڱ�֤O2Ũ�Ȳ��������£�����������������Ը���ƽ�ⳣ�����ж�ƽ�� ______ ![]() ���������ƶ������������ƶ����������ƶ���
���������ƶ������������ƶ����������ƶ���![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
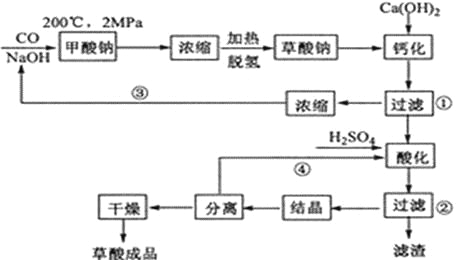
����Ŀ�����ᣨ�Ҷ��ᣩ������ԭ���ͳ����������ڽ������⡢֯��Ư��ϡ��������һ���Ʊ����ᣨ��2���ᾧˮ���Ĺ����������£�
�ش��������⣺
��1��CO��NaOH��һ�������ºϳɼ����ơ������Ƽ�������Ļ�ѧ��Ӧ����ʽ�ֱ�Ϊ______________________________��_______________________________________��
��2�����Ʊ������������ι��˲��������˲����ٵ���Һ��_______��������_______�����˲����ڵ���Һ��__________��___________��������______________��
��3�����չ����Тۺܵ͢�Ŀ����____________________________________��
��4�����˽�������������ֱ���������ữ�Ʊ����ᡣ�÷�����ȱ���Dz�Ʒ���������к��е�������Ҫ��_____________��
��5���ᾧˮ�ϲ����Ʒ�Ĵ����ø�����ط��ⶨ�����������Ʒ0.250g����ˮ�У���0.0500 mol��L-1������KMnO4��Һ�ζ������ۺ�ɫ�����ʣ�����KMnO4��Һ15.00mL����Ӧ�����ӷ���ʽΪ__________________________����ʽ����ó�Ʒ�Ĵ���________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com