
【题目】草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下:
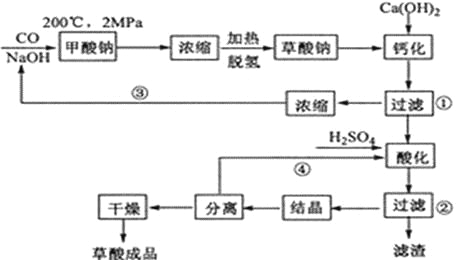
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为______________________________、_______________________________________。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是_______,滤渣是_______;过滤操作②的滤液是__________和___________,滤渣是______________。
(3)工艺过程中③和④的目的是____________________________________。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是_____________。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250g溶于水中,用0.0500 mol·L-1的酸性KMnO4溶液滴定,至粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为__________________________;列式计算该成品的纯度________________。
【答案】CO + NaOH![]() HCOONa 2HCOONa
HCOONa 2HCOONa![]() Na2C2O4+ H2↑ NaOH溶液 CaC2O4 H2C2O4溶液 H2SO4溶液 CaSO4 分别循环利用氢氧化钠和硫酸(降低成本),减小污染 Na2SO4 5C2O42-+ 2MnO4-+ 16H+= 2Mn2++ 8H2O + 10CO2↑
Na2C2O4+ H2↑ NaOH溶液 CaC2O4 H2C2O4溶液 H2SO4溶液 CaSO4 分别循环利用氢氧化钠和硫酸(降低成本),减小污染 Na2SO4 5C2O42-+ 2MnO4-+ 16H+= 2Mn2++ 8H2O + 10CO2↑ 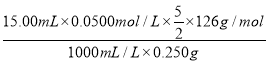 ×100%=94.5%
×100%=94.5%
【解析】
(1)根据工艺流程图可知:CO和NaOH在一定条件下合成甲酸钠方程式为CO + NaOH![]() HCOONa,甲酸钠加热脱氢的化学反应方程式为2HCOONa
HCOONa,甲酸钠加热脱氢的化学反应方程式为2HCOONa![]() Na2C2O4+ H2↑。
Na2C2O4+ H2↑。
(2)“钙化”发生的反应为Na2C2O4+Ca(OH)2=CaC2O4↓+2NaOH,过滤操作①的滤液是NaOH溶液,滤渣是CaC2O4;CaC2O4中加入硫酸酸化,发生反应CaC2O4+H2SO4=CaSO4+H2C2O4,结合流程,过滤操作②的滤液是H2C2O4溶液和H2SO4溶液,滤渣是CaSO4。
(3)根据工艺过程可知,工艺③可以循环利用氢氧化钠,工艺④可以循环利用硫酸,既提高了原料的利用率,又降低了成本,减小污染。
(4)甲酸钠脱氢后的产物为草酸钠,直接用硫酸酸化,生成草酸和硫酸钠,其中含有的杂质主要是Na2SO4。
(5)在测定过程中,高锰酸钾为氧化剂,草酸为还原剂,反应的离子方程式5C2O42-+ 2MnO4-+ 16H+= 2Mn2++ 8H2O + 10CO2↑;根据方程式可得关系式:5H2C2O4·2H2O ~ 2KMnO4,n(H2C2O4·2H2O)=![]() n(KMnO4)=
n(KMnO4)=![]() ×0.0500mol/L×
×0.0500mol/L×![]() ,则m(H2C2O4·2H2O)=
,则m(H2C2O4·2H2O)=![]() ×0.0500mol/L×
×0.0500mol/L×![]() ×126g/mol,所以成品的纯度ω=
×126g/mol,所以成品的纯度ω=![]() ×0.0500mol/L×
×0.0500mol/L×![]() ×126g/mol ÷0.250g=
×126g/mol ÷0.250g=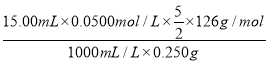 ×100%=94.5%。
×100%=94.5%。


科目:高中化学 来源: 题型:
【题目】1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均釆用虚线表示。
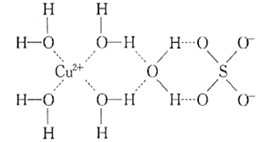
(1)写出与Cu在同一周期且未成对电子数最多的基态原子的电子排布式:______ ,S原子的价层电子排布图______________。
(2)写出胆矾晶体中水合铜离子的结构简式______________(必须将配位键表示出来)。
(3)向胆矾溶液中滴加氨水至过量,最终得到深蓝色的透明溶液,再加入乙醇后析出深蓝色晶体,写出生成深蓝色透明溶液的离子方程式__________。比较NH3和[Cu(NH3)4]2+中H-N-H 中键角的大小:NH3______[Cu(NH3)4]2+(填“>” “<” 或“=”)。
(4)已知H2O2的结构如图:
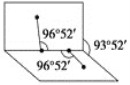
H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′,估计它难溶于CS2,简要说明原因__________________________。
(5)Co3+形成的化合物[Co(NH3)5N3]SO4中Co的配位数为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y原子的最外层电子数是电子层数的2倍,Z是地壳中含量最高的非金属元素,Q元素形成的单质是重要的半导体材料,R元素原子核外的M电子层电子数比L层少2个。请回答下列问题:
(1)画出Z的原子结构示意图__________,其氢化物的电子式__________。
(2)![]() 、Z、Q三种元素的原子半径由大到小的顺序__________
、Z、Q三种元素的原子半径由大到小的顺序__________![]() 用元素符号表示
用元素符号表示![]() 。
。
(3)![]() 元素在周期表中的位置_________,与Q同主族第四周期的元素的原子序数是_____,在周期表的以下区域中,可以找到类似的半导体材料的是__________
元素在周期表中的位置_________,与Q同主族第四周期的元素的原子序数是_____,在周期表的以下区域中,可以找到类似的半导体材料的是__________![]() 填字母序号
填字母序号![]() 。
。
![]() 过渡元素区域
过渡元素区域
![]() 金属和非金属元素的分界线附近
金属和非金属元素的分界线附近
![]() 含有氟、氯、硫、磷等元素的区域
含有氟、氯、硫、磷等元素的区域
![]() 下列能说明Y与R元素非金属性相对强弱的是__________。
下列能说明Y与R元素非金属性相对强弱的是__________。
![]() 单质与氢气化合的难易程度
单质与氢气化合的难易程度
![]() 含氧酸的酸性:
含氧酸的酸性:![]()
![]() 与R相互形成的化合物中元素的化合价
与R相互形成的化合物中元素的化合价
Ⅱ![]() 已知:
已知:
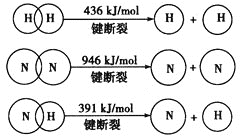
合成氨的热化学方程式是___________________________________。
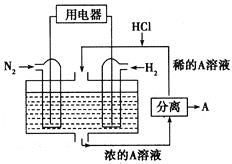
Ⅲ![]() 有人设想以
有人设想以![]() 和
和![]() 为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。正极的电极方程式为_________。
为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。正极的电极方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水存在如下电离:H2O![]() H++OH- H>0,下列叙述正确的是
H++OH- H>0,下列叙述正确的是
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体NH4Cl,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸钠,c(H+)=10-7mol/L,Kw不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )
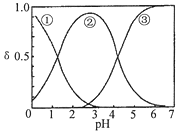
A. 曲线①代表的粒子是HC2O4-
B. 0.1 molL-1NaHC2O4溶液中:c(C2O42-)>c(H2C2O4)
C. pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-)
D. 一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修3:物质结构与性质】铜元素可形成多种重要化合物。回答下列问题:
(1)铜元素位于元素周期表中的_____区,其基态原子的价电子排布图为_________。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是__________。
②在[Cu(NH3)4]SO4中,Cu2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_________。
③除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为________。
④NF3与NH3的空间构型相同,中心原子的轨道杂化类型均为_________。但NF3不易与Cu2+形成化学键,其原因是_______________。
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。

①该物质的化学式为__________。
②已知该晶胞中两个Ba2+的间距为cpm.则距离Ba2+最近的Hg+数目为_____个,二者的最短距离为_______pm。(列出计算式即可,下同)
③设该物质的摩尔质量为M,阿伏加德罗常数的值为NA,则该晶体的密度为______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种重要的精细化工产品,被广泛用于制药、染料、农药及日用化工。以下为其中一种合成二甲醚的方法:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5kJ·mol-1
③2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=________kJ·mol-1。
(2)某温度下在容积为2L的密闭容器中加入CH3OH(g)发生反应②,测得有关数据如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 |
n(CH3OH)/mol | 1.02 | 0.4 | 0.2 | 0.02 | 0.02 |
①前2min内,H2O(g)的平均反应速率为________mol·L-1·min-1;此反应在该温度下的平衡常数为________;若再向容器中分别加入CH3OH(g)0.02mol、CH3OCH3(g)1.0mol,此时该反应中υ正________υ逆(填“>”、“<”或“=”)。
②根据文献,甲醇的转化率可以根据冷凝的液相中甲醇与水的百分含量来计算(忽略挥发到气相的甲醇),若以A表示冷凝液中水的质量分数,B表示冷凝液中甲醇的质量分数,则甲醇的转化率α(CH3OH)=________。
(3)一定条件下,发生反应③,原料气中![]() 和温度对CO2转化率影响的实验数据如图所示。
和温度对CO2转化率影响的实验数据如图所示。

结合图像,可得出CO2平衡转化率受外界条件影响的变化规律为:
a:________;
b:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,醋酸、氢硫酸、氢氰酸的电离平衡常数如下表:(单位省略)
醋酸 | 氢硫酸 | 氢氰酸 |
Ka=1.8×10-5 | Ka1=9.1×10-8 Ka2=1.1×10-12 | Ka=4.9×10-10 |
(1)体积相同、c(H+)相同的三种酸溶液a.CH3COOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)___________。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为_____________(填序号)。
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,阴离子总浓度由大到小的顺序为 _____________(填序号)。
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是_______。
a.c(H+)<c(OH-) b.c(H+)+c(HCN)=c(OH-)+c(CN-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,向NaCN溶液中通入少量H2S,反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物J是一种常用的抗组胺药物,一种合成路线如下:
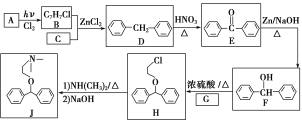
已知:①C为最简单的芳香烃,且A、C互为同系物。
②2ROH+NH3![]() HNR2+2H2O(R代表烃基)。
HNR2+2H2O(R代表烃基)。
请回答下列问题:
(1)A的化学名称是___________,H中的官能团名称是_________________。
(2)由D生成E的反应类型是________,G的结构简式为_______________。
(3)B+C―→D的化学方程式为_____________________________________。
(4)L是F的同分异构体,含有联苯(![]() )结构,遇FeCl3溶液显紫色,则L有_______种(不考虑立体异构)。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为___________________。
)结构,遇FeCl3溶液显紫色,则L有_______种(不考虑立体异构)。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为___________________。
(5)写出用氯乙烷和2氯1丙醇为原料制备化合物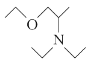 的合成路线(其他无机试剂任选)。________________
的合成路线(其他无机试剂任选)。________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com