
【题目】H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )
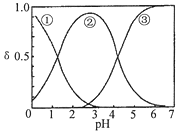
A. 曲线①代表的粒子是HC2O4-
B. 0.1 molL-1NaHC2O4溶液中:c(C2O42-)>c(H2C2O4)
C. pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-)
D. 一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变
【答案】B
【解析】试题分析:A、曲线①代表的粒子是H2C2O4,故A错误;B、NaHC2O4溶液pH=4,证明溶液显示酸性,阴离子HC2O4-的电离程度大于其水解程度,所以c(H2C2O4)<c(C2O42-),故B正确;C、pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(HC2O4-)>c(H2C2O4),故C错误;D、一定温度下,往CaC2O4饱和溶液中,存在CaC2O4(s)![]() C2O42-(aq)+Ca2+(aq)平衡,加入少量CaCl2固体,平衡逆向移动,c(C2O42-)将减小,c(Ca2+)不可抵消,所以c(Ca2+)增大,故D错误;故选B。
C2O42-(aq)+Ca2+(aq)平衡,加入少量CaCl2固体,平衡逆向移动,c(C2O42-)将减小,c(Ca2+)不可抵消,所以c(Ca2+)增大,故D错误;故选B。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,发生反应:①M(s)+N(g) ![]() R(g) △H=—Q1 kJ/mol,②2R(g)+N(g)
R(g) △H=—Q1 kJ/mol,②2R(g)+N(g) ![]() 2T(g) △H=—Q2 kJ/mol.Q1、Q2、Q3均为正值.下列说法正确的是 ( )
2T(g) △H=—Q2 kJ/mol.Q1、Q2、Q3均为正值.下列说法正确的是 ( )
A.1mol R(g)的能量总和大于1mol M(s)与1mol N(g)的能量总和
B.将2mol R(g)与1mol N(g)在该条件下反应,可以放出热量Q2 kJ
C.当1mol M(s)完全转化为T(g)时(假定无热量损失),放出热量![]()
D.M(g)+N(g) ![]() R(g) △H=—Q3 kJ/mol,则Q3 >Q1
R(g) △H=—Q3 kJ/mol,则Q3 >Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是( )

A.粗盐水中含Ca2+、Mg2+、SO42-等离子,精制时除杂试剂BaCl2溶液应在Na2CO3溶液之前加入
B.标准状况下每生成22.4LCl2,便产生2 mol NaOH
C.从E口逸出的气体是Cl2
D.从B口加入含少量NaOH的水溶液以增强导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A.NaHCO3溶液中:c(H+) +c(H2CO3)=c(CO32-) +c(OH-)
B.25℃时,0.2mol·L-1盐酸与等体积0.05 mol·L-1Ba(OH)2溶液混合后,溶液的pH=1
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=c(Na+)
D.25℃时,若0.3 mol·L-1 HY溶液与0.3 mol·L-1 NaOH溶液等体积混合后,溶液的pH=9,则:c(OH-)-c(HY)=c(H+)=1×10-9 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下:
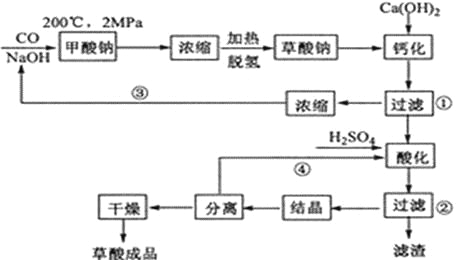
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为______________________________、_______________________________________。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是_______,滤渣是_______;过滤操作②的滤液是__________和___________,滤渣是______________。
(3)工艺过程中③和④的目的是____________________________________。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是_____________。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250g溶于水中,用0.0500 mol·L-1的酸性KMnO4溶液滴定,至粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为__________________________;列式计算该成品的纯度________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
铬、锰、铁、钴、镍等过渡金属元索的单质及其化合物在工农业、国防、科技等领域具存广泛应用。
(1)基态Cr原子中有_________个未成对电子,最外层电子所占用能级的电子云形状为_______。
(2)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关,一般地,为d0或d10排布时,无颜色;为d1d9排布时,有颜色。则:[Mn(H2O)6]2+ ________(填“无”或“有”)颜色。
(3)不同温度下,铁单质晶胞的两种堆积方式如图所示

①图1和图2中Fe原子的配位数分别为_______________和________________。
②若图2的晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶胞中两个最近的Fe原子之间的距离为__________pm。(用含ρ、NA的代数式表示)
(4)已知MgO与NiO的晶体结构(如图3)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO__________NiO(填“>”“<”或“=”),理由是_______________。若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________。
(5)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图4),已知O2-的半径为ɑ m,每平方米面积上分散的该晶体的质量为_________g。(用含ɑ、NA的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,可达到对应实验目的的是( )
实验操作 | 实验目的 | |
A | 苯和溴水混合后加入铁粉 | 制溴苯 |
B | 某有机物与溴的四氯化碳溶液混合 | 确认该有机物含碳碳双键 |
C | 将 | 检验该有机物中的溴原子 |
D | 乙醇与酸性高锰酸钾溶液混合 | 检验乙醇具有还原性 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com