
【题目】下列实验操作中,可达到对应实验目的的是( )
实验操作 | 实验目的 | |
A | 苯和溴水混合后加入铁粉 | 制溴苯 |
B | 某有机物与溴的四氯化碳溶液混合 | 确认该有机物含碳碳双键 |
C | 将 | 检验该有机物中的溴原子 |
D | 乙醇与酸性高锰酸钾溶液混合 | 检验乙醇具有还原性 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】配制100mL1.0mol·L-1的NaOH溶液,下列情况不会影响溶液浓度的是
A. 容量瓶使用前有蒸馏水
B. 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C. 俯视确定凹液面与刻度线相切
D. 称量NaOH固体时使用了称量纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸厂烧渣(主要成分是Fe2O3,其次含少量的SiO2和FeS)经回收处理可制得绿矾(FeSO4·7H2O)和一种重要的水处理剂聚铁胶体[Fe(OH)SO4]n,上述生产工艺流程如下:

请通过分析回答下列相关问题:
(1)操作Ⅰ的名称是 _____。
(2)灼烧产生的尾气对大气有污染,因此工业生产中必须进行回收处理,下列方法可行的是____________。
A.直接用水吸收 B. 用氨水吸收
C. 用浓硫酸吸收 D. 与空气混合用石灰石粉末悬浊液吸收
(3)操作Ⅲ经蒸发浓缩、___________、过滤、____、干燥等。
(4)在由溶液X制聚铁胶体过程中①调节pH及②控制温度目的是_________。
(5)检验溶液X中金属阳离子所加试剂是______,其现象是___________ 。
(6)溶液X转化为溶液Y需加入一种常见物质是 ____________ 。
(7)在反应釜中FeS、O2及稀H2SO4反应生成硫酸铁等物质,则反应的离子方程式是________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态化合物X含C,H,O三种元素,现已知下列条件:①X中C的质量分数;②X中H的质量分数;③X在标准状况下的体积;④X对氢气的相对密度;⑤X的质量,欲确定X的分子式,所需的最少条件是 ( )
A.①③⑤B.②③④C.①②④D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。常温常压下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体。(反应中生成的部分物质已略去)

请回答下列问题:
(1)物质A的化学式为________;
(2)化合物I的化学式为________;
(3)反应①的化学方程式为_____________;反应②的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示.下列有关混合气体的说法正确的是( )
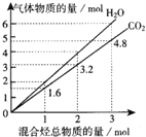
A. 该混合气体一定含有乙烯
B. 该混合气体一定含甲烷和乙炔
C. 在常温下,该混合气体与足量氧气混合,完全燃烧后恢复至常温燃烧前后总体积不变
D. 若混合气体由CH4和C2H4组成,则其体积比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂排出的废液主要含有硝酸锌和硝酸银,为了从中回收金属银和硝酸锌,某中学化学课外活动小组设计了以下的实验步骤:

(1)X是____________,Y是____________ (写化学式,下同)。
(2)固体A、滤液B、C的主要成分:A______________,B______________,C______________。
(3)Z处进行的操作是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.Mg的摩尔质量为24
B.物质的量的基本单位是摩尔
C.常温常压下,1 mol O2体积为22.4L
D.将1 mol NaCl晶体加入到1L水中,得到NaCl溶液的浓度就是1mol L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是第34号元素,是人体内不可或缺的微量元素,可以形成H2Se、SeO2、H2SeO3、H2SeO4、CuSe等多种化合物。请回答下列问题:
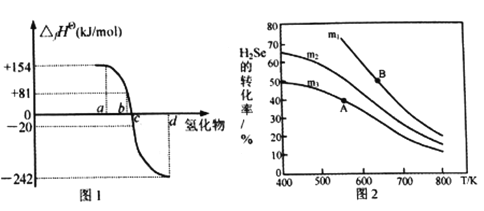
(1)硒在元素周期表中的位置________________________。
(2)在101kPa、一定温度(一般是298K)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的标准生成热(△fHθ)。图1为氧族元素氢化物a、b、c、d呈气态时的生成热数据。
①图1中氢化物d的电子式为__________________________。
②在298K时,硒化氢分解反应的热化学反应方程式为__________________________。
③由图中数据计算,2H2Se(g)+O2(g) ![]() 2Se(s)+2H2O(g) △H=_____________KJ/mol
2Se(s)+2H2O(g) △H=_____________KJ/mol
(3)在恒容反应器中,将H2Se(g)和O2(g)按不同比例[n(H2Se)/n(O2)=m]投入反应器,测得反应2H2Se(g)+O2(g) ![]() 2Se(s)+2H2O(g)中H2Se的平衡转化率随温度变化如图2所示。则A、B两点平衡常数大小关系为KA________KB(填“<”、“>”或“=”),图中m1、m2、m3由大到小的顺序为 ____________,理由是____________________________________。
2Se(s)+2H2O(g)中H2Se的平衡转化率随温度变化如图2所示。则A、B两点平衡常数大小关系为KA________KB(填“<”、“>”或“=”),图中m1、m2、m3由大到小的顺序为 ____________,理由是____________________________________。
(4)常温下溶度积:Ksp(CuSe)=7.9x10-49,Ksp(CuS)=1.3×10-36。则反应CuS(s)+Se2-(aq) ![]() CuSe(s)+S2-(aq)的化学平衡常数K为____________(结果用科学记数法表示,并保留2位小数)。当溶液中c(S2-)=100c(Se2-)时,反应中v(正)_____v(逆)(填“<”、“>”或“=”) 。
CuSe(s)+S2-(aq)的化学平衡常数K为____________(结果用科学记数法表示,并保留2位小数)。当溶液中c(S2-)=100c(Se2-)时,反应中v(正)_____v(逆)(填“<”、“>”或“=”) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com