
【题目】如图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是( )

A.粗盐水中含Ca2+、Mg2+、SO42-等离子,精制时除杂试剂BaCl2溶液应在Na2CO3溶液之前加入
B.标准状况下每生成22.4LCl2,便产生2 mol NaOH
C.从E口逸出的气体是Cl2
D.从B口加入含少量NaOH的水溶液以增强导电性
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知在![]() 的
的![]() ,溶液中有关粒子浓度由大到小的顺序为
,溶液中有关粒子浓度由大到小的顺序为![]() 。
。
(1)该溶液中![]() ________
________![]() (填“>”“=”或“<”),简述理由:_______________________________________________________________
(填“>”“=”或“<”),简述理由:_______________________________________________________________
(2)现向![]() 溶液中,逐滴加入少量含有酚酞的
溶液中,逐滴加入少量含有酚酞的![]() 溶液,可观察到的现象是__________________________________________________________;写出该反应的离子方程式:____________________________________。
溶液,可观察到的现象是__________________________________________________________;写出该反应的离子方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,不正确的是![]()
![]()
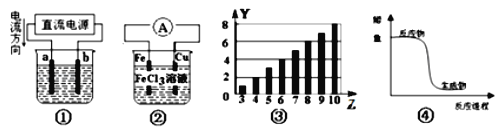
A.用装置①电解氯化铜溶液,则a为阳极,发生氧化反应
B.装置②为原电池,总反应是:![]()
C.图③所示柱形图,纵坐标表示第二周期元素最高正价随原子序数的变化
D.图④所示曲线,表示该反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和碳的化合物广泛的存在于我们的生活中。
(1)根据下列反应的能量变化示意图,![]() ______ 。
______ 。

(2)在体积为2L的密闭容器中,充入1mol ![]() 和3mol H,一定条件下发生反应:
和3mol H,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的物质的量随时间变化的曲线如图所示:
的物质的量随时间变化的曲线如图所示:
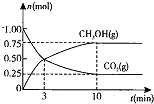
①从反应开始到平衡,![]() 的平均反应速率
的平均反应速率![]() ______ 。
______ 。
②下列措施中能使化学平衡向正反应方向移动的是 ______ ![]() 填编号
填编号![]() 。
。
A.升高温度
![]() 将
将![]() 及时液化移出
及时液化移出
C.选择高效催化剂
![]() 再充入1mol
再充入1mol ![]() 和4mol
和4mol ![]()
(3)![]() 溶于水生成碳酸。已知下列数据:
溶于水生成碳酸。已知下列数据:
弱电解质 |
|
|
电离平衡常数 |
|
|
现有常温下![]() 的
的![]() 溶液,已知:
溶液,已知:![]() 水解的平衡常数
水解的平衡常数![]() ,
,![]() 第一步水解的平衡常数
第一步水解的平衡常数![]() 。
。
①判断该溶液呈 ______ ![]() 填“酸”、“中”、“碱”
填“酸”、“中”、“碱”![]() 性,写出该溶液中
性,写出该溶液中![]() 发生第一步水解的离子方程式 ______ 。
发生第一步水解的离子方程式 ______ 。
②下列粒子之间的关系式,其中正确的是 ______ 。
A.![]()
B.![]()
C.![]()
D.![]()
(4)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特殊电极材料以CO和![]() 为原料做成电池。原理如图所示:
为原料做成电池。原理如图所示:
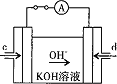
通入CO的管口是 ______ ![]() 填“c”或“d”
填“c”或“d”![]() ,写出该电极的电极反应式: ______ 。
,写出该电极的电极反应式: ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经检测某工厂的酸性废水中所含离子及其浓度如下表所示:
离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
(1)c(H+)= mol/L。
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O)。

① 工业废水中加入铁粉后,反应的离子方程式为:
Fe + Cu2+ == Fe2+ + Cu、 、 。
② 试剂B是 。
③ 操作③是蒸发浓缩、冷却结晶、 ,最后用少量冷水洗涤晶体,在低温下干燥。
④ 通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是 。
⑤ 获得的FeSO4·7H2O需密闭保存,原因是 。
⑥ 上述1000 L废水经处理,可获得 FeSO4·7H2O的物质的量是 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y原子的最外层电子数是电子层数的2倍,Z是地壳中含量最高的非金属元素,Q元素形成的单质是重要的半导体材料,R元素原子核外的M电子层电子数比L层少2个。请回答下列问题:
(1)画出Z的原子结构示意图__________,其氢化物的电子式__________。
(2)![]() 、Z、Q三种元素的原子半径由大到小的顺序__________
、Z、Q三种元素的原子半径由大到小的顺序__________![]() 用元素符号表示
用元素符号表示![]() 。
。
(3)![]() 元素在周期表中的位置_________,与Q同主族第四周期的元素的原子序数是_____,在周期表的以下区域中,可以找到类似的半导体材料的是__________
元素在周期表中的位置_________,与Q同主族第四周期的元素的原子序数是_____,在周期表的以下区域中,可以找到类似的半导体材料的是__________![]() 填字母序号
填字母序号![]() 。
。
![]() 过渡元素区域
过渡元素区域
![]() 金属和非金属元素的分界线附近
金属和非金属元素的分界线附近
![]() 含有氟、氯、硫、磷等元素的区域
含有氟、氯、硫、磷等元素的区域
![]() 下列能说明Y与R元素非金属性相对强弱的是__________。
下列能说明Y与R元素非金属性相对强弱的是__________。
![]() 单质与氢气化合的难易程度
单质与氢气化合的难易程度
![]() 含氧酸的酸性:
含氧酸的酸性:![]()
![]() 与R相互形成的化合物中元素的化合价
与R相互形成的化合物中元素的化合价
Ⅱ![]() 已知:
已知:
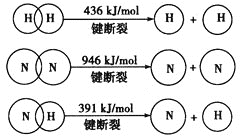
合成氨的热化学方程式是___________________________________。
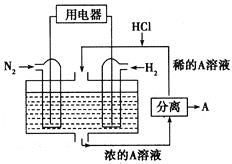
Ⅲ![]() 有人设想以
有人设想以![]() 和
和![]() 为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。正极的电极方程式为_________。
为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。正极的电极方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门实用性很强的科学,与社会、环境等密切相关。下列说法错误的是
A.用![]() 合成可降解的聚碳酸酯塑料,能减少白色污染及其危害
合成可降解的聚碳酸酯塑料,能减少白色污染及其危害
B.用含橙色酸性重铬酸钾的仪器检验酒驾,利用了乙醇的挥发性和还原性
C.浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果
D.“煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )
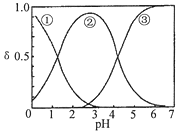
A. 曲线①代表的粒子是HC2O4-
B. 0.1 molL-1NaHC2O4溶液中:c(C2O42-)>c(H2C2O4)
C. pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-)
D. 一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技的进步,合理利用资源保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) △H。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) △H。已知该反应中相关化学键的键能数据如下:

则该反应的△H=___________kJ·mol-1
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为:CO(g)+2H2(g) CH3 OH(g) △H<O
在一定条件下,将1 mol CO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH2OH的体积分数![]() (CH3OH)变化趋势如图所示:
(CH3OH)变化趋势如图所示:

①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为___________。
②某同学认为上图中Y轴表示温度,你认为他判断的理由是______________________。
(3)合成甲醇所需的氢气,工业上常从一种合成气(主要成分为CO2、H2)中分离。H2提纯过程示意图如下:

①吸收池中发生反应的离子方程式是___________。
②用电极反应式和离子方程式表示K2CO3溶液的再生原理___________。
(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g) 2HI(g)的△H=___________0(填“大于”或“小于”)。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O=3H++HSO4-+2I-,I2+I-I3-,图2中曲线b代表的微粒是___________(填微粒符号),由图2可知,要提高碘的还原率,除控制温度外,还可以采取的措施是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com