
【题目】关于下列各装置图的叙述中,不正确的是![]()
![]()
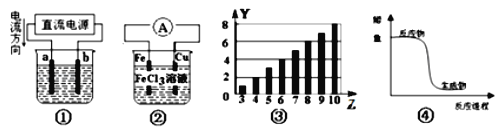
A.用装置①电解氯化铜溶液,则a为阳极,发生氧化反应
B.装置②为原电池,总反应是:![]()
C.图③所示柱形图,纵坐标表示第二周期元素最高正价随原子序数的变化
D.图④所示曲线,表示该反应是放热反应
科目:高中化学 来源: 题型:
【题目】室温下,用相同物质的量浓度的 HC1 溶液,分别滴定物质的量浓度均为 0.1 mol/L 的三种碱溶液,滴定 曲线如图所示。下列判断正确的是

A. 滴定前,三种碱溶液中水电离出的 c(H+)大小关系: DOH>BOH>AOH
B. pH= 7 时,c(A+)=c(B+)=c(D+)
C. 滴定至 P 点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
D. 当中和百分数达 100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是![]()
A. 如图表示同温度下,
如图表示同温度下,![]() 的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B. 如图表示
如图表示![]()
![]() 溶液滴定
溶液滴定![]()
![]()
![]() 溶液所得到的滴定曲线
溶液所得到的滴定曲线
C. 如图表示压强对可逆反应
如图表示压强对可逆反应![]() 的影响,乙的压强比甲的压强大
的影响,乙的压强比甲的压强大
D. 如图若除去
如图若除去![]() 溶液中的
溶液中的![]() 可向溶液中加入适量CuO至pH在4左右
可向溶液中加入适量CuO至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,发生反应:①M(s)+N(g) ![]() R(g) △H=—Q1 kJ/mol,②2R(g)+N(g)
R(g) △H=—Q1 kJ/mol,②2R(g)+N(g) ![]() 2T(g) △H=—Q2 kJ/mol.Q1、Q2、Q3均为正值.下列说法正确的是 ( )
2T(g) △H=—Q2 kJ/mol.Q1、Q2、Q3均为正值.下列说法正确的是 ( )
A.1mol R(g)的能量总和大于1mol M(s)与1mol N(g)的能量总和
B.将2mol R(g)与1mol N(g)在该条件下反应,可以放出热量Q2 kJ
C.当1mol M(s)完全转化为T(g)时(假定无热量损失),放出热量![]()
D.M(g)+N(g) ![]() R(g) △H=—Q3 kJ/mol,则Q3 >Q1
R(g) △H=—Q3 kJ/mol,则Q3 >Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奈必洛尔是一种用于血管扩张的降血压药物,一种合成奈必洛尔中间体G的部分流程如下:
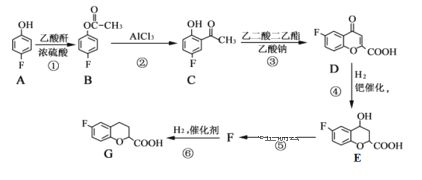
已知:乙酸酐的结构简式为![]()
请回答下列问题:
(1)A的名称是____________;B中所含官能团的名称是___________________。
(2)反应⑤的化学方程式为_____________,该反应的反应类型是______。
(3)G的分子式为_________,乙酸酐共面的原子最多有_____个
(4)写出同时满足下列条件的E的同分异构体的结构简式:_______。
a.苯环上只有三个取代基
b核磁共振氢谱图中只有4组吸收峰
c.1mol该物质与足量NaHCO3溶液反应生成2molCO2
(5)根据已有知识并结合相关信息,写出以![]() 和乙酸酐为原料制备
和乙酸酐为原料制备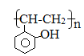 的合成路线流程图________________(无机试剂任选),合成路线流程图示例如下: CH3CH2Br
的合成路线流程图________________(无机试剂任选),合成路线流程图示例如下: CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原滴定同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.0010 mol·L1酸性KMnO4溶液滴定未知浓度的无色NaHSO3溶液,反应的离子方程式为2![]() +5
+5![]() +H+=2Mn2++5
+H+=2Mn2++5![]() +3H2O。请完成下列问题:
+3H2O。请完成下列问题:
(1)该实验除了滴定管(50 mL)、铁架台、滴定管夹、烧杯 、白纸等仪器和用品外,还必须使用的仪器是____________。
(2)实验中用_____(填“酸”或“碱”)式滴定管盛装酸性KMnO4溶液,原因是_______。
(3)本实验_______(填“需要”或“不需要”)使用指示剂,滴定终点的现象是__________。
(4)①滴定前平视液面,刻度为a mL,滴定后俯视刻度为b mL,根据(ba) mL计算得到的待测液浓度比实际浓度_____(填“高”或“低”)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的待测液浓度值会____(填“偏小”“偏大”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对制革工业污泥中铬的处理工艺流程如下:
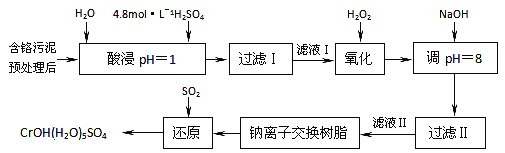
已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有_________、___________。(答出两点)。
(2)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 5.4(>8溶解) | 9(>9溶解) |
①用NaOH调节溶液的pH不能超过8,其理由是________________________________。
②常温下,当pH=8时,Mg2+是否开始沉淀(溶液中镁离子浓度不超过1mol·L-1)___________ 。 (填“是”或“否”)若要使Mg2+完全沉淀,溶液的pH至少为_________(已知Ksp[Mg(OH)2]=1. 6×10-12,lg2=0.3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是( )

A.粗盐水中含Ca2+、Mg2+、SO42-等离子,精制时除杂试剂BaCl2溶液应在Na2CO3溶液之前加入
B.标准状况下每生成22.4LCl2,便产生2 mol NaOH
C.从E口逸出的气体是Cl2
D.从B口加入含少量NaOH的水溶液以增强导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com