
【题目】如下表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(1)③④⑦的原子半径由大到小的顺序为____(用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为____(用酸的化学式表示)。
(3)②④两种元素按原子个数之比为1:1组成的化合物的电子式____。
(4)①②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式___。
(5)表中⑤的单质和④的最高价氧化物水化物反应的化学方程式为____。
【答案】Na>Cl>F HClO4>H2SO4 ![]() 2H++2Fe2++H2O2=2Fe3++2H2O Si+2NaOH+H2O=Na2SiO3+2H2↑
2H++2Fe2++H2O2=2Fe3++2H2O Si+2NaOH+H2O=Na2SiO3+2H2↑
【解析】
根据元素在周期表中的位置可知①是H元素;②是O元素,③是F元素,④是Na元素,⑤是Si元素,⑥是S元素,⑦是Cl元素,以此解答。
(1)同一周期的元素原子序数越大,原子半径越小;同一主族的元素原子核外电子层数越多,原子半径就越大;
(2)元素的非金属性越强,其最高价含氧酸的酸性越强;
(3)②④两种元素按原子个数之比为1:1组成的化合物为Na2O2,Na2O2是钠离子和过氧根离子构成的离子化合物;
(4)①是H元素;②是O元素,两种元素按原子个数之比为1:1组成的常见液态化合物是H2O2,根据电子守恒、原子守恒和电荷守恒可得该反应的离子方程式;
(5)⑤是Si元素,④是Na元素最高价氧化物水化物是NaOH。
(1)根据元素在周期表中的位置可知③是F元素,④是Na元素,⑦是Cl元素。同一周期的元素原子序数越大,原子半径越小;同一主族的元素原子核外电子层数越多,原子半径就越大,因此这三种元素的原子半径由大到小的顺序为Na>Cl>F;
(2)根据元素在周期表中的位置可知⑥是S元素,⑦号元素是Cl,元素的非金属性越强,其最高价含氧酸的酸性越强。元素的非金属性Cl>S,所以最高价含氧酸的酸性越强强弱为HClO4>H2SO4;
(3)②④两种元素按原子个数之比为1:1组成的化合物为Na2O2,Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为![]() ;
;
(4)①是H元素;②是O元素,两种元素按原子个数之比为1:1组成的常见液态化合物是H2O2,有强的氧化性,在酸性溶液中能将Fe2+氧化,根据电子守恒、原子守恒和电荷守恒可得该反应的离子方程式是H2O2+2Fe2++2H+=2Fe3++2H2O;
(5)⑤是Si元素,④是Na元素最高价氧化物水化物是NaOH,Si和氢氧化钠反应生成硅酸钠、水和氢气,方程式为:Si+2NaOH+H2O=Na2SiO3+2H2↑。


科目:高中化学 来源: 题型:
【题目】填空
(1)![]() 的名称是 ______ ;
的名称是 ______ ;
(2) 的名称是 ______ ;
的名称是 ______ ;
(3) 的含氧官能团的名称___________________________________
的含氧官能团的名称___________________________________
(4)实验测定某有机物元素质量组成为C:69% H:4.6% N:8.0%,其余是O,该有机物的实验式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物FeCl2、FeCl3、CuCl2、Cu;
(1)将上述反应设计成的原电池如图甲所示请回答下列问题:

①图中X溶液是__;
②Cu电极上发生的电极反应式为__;
③原电池工作时,盐桥中的__填“K+”或“Cl-”)不断进入X溶液中。
(2)将上述反应设计成电解池如图乙所示乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是电源的__极;
②图丙中的②线是__的变化;
③当电子转移为0.2mol时向乙烧杯中加入__L5mol/LNaOH溶液才能使所有的金属阳离子沉淀完全。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,平且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。
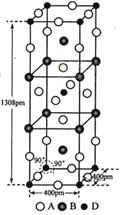
①该化合物的化学式为_________________;D的配位数为___________;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____________;该化合物中存在一个复杂离子,该离子的化学式为_______________,配位体是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用粗ZnO(含FeO、CuO)制取金属锌的流程如下(部分步骤省略):

已知:几种离子形成氢氧化物沉淀时的pH如下表:
待沉淀的离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
开始沉淀时pH | 6.3 | 1.5 | 6.2 | 5.2 |
沉淀完全时pH | 9.7 | 3.2 | 8.0 | 6.4 |
请回答下列问题:
(1)酸浸粗氧化锌的过程中,为了加快酸浸速率,可采取的措施有______________ (写出一点即可)。
(2)步骤A的目的是将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2、Zn(OH)2,该步骤需控制溶液pH的范围是______________,该步骤中加入H2O2发生反应的离子方程式为_______________________________________。
(3)步骤D的操作名称为________________________________________________。
(4)由粗ZnO制取单质锌的另一种方法是将粗ZnO(含FeO、CuO)溶于NaOH溶液,ZnO全
部转化为Na2[Zn(OH)4]溶液,该反应的化学方程式为_________________________;然后将FeO、CuO过滤除去;再用惰性电极电解该滤液,阳极上逸出无色无味气体,阴极上析出锌,则阴极电极反应式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,二元弱酸H2R的pKa1=1.85,pKa2=7.45(已知pKa=-lgKa)。在此温度下向20mL0.1molL-1H2R溶液中滴加0.1molL-1的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。

下列有关说法正确的是( )
A. a点所示溶液中:c(H2R)+c(HR-)+c(R2-)=0.1molL-1
B. b点所示溶液中:c(Na+)>c(HR-)>c(H2R)>c(R2-)
C. c点溶液中水电离程度大于d点溶液
D. d点所示溶液中:c(Na+)>c(R2-)>c(HR-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述中一定正确的是![]()
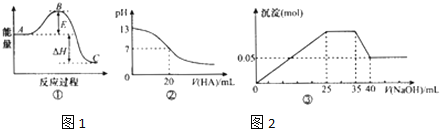
A.若图①中曲线表示![]() ,反应过程的能量变化.则升温或使用催化剂,均会使B点降低,反应速率加快
,反应过程的能量变化.则升温或使用催化剂,均会使B点降低,反应速率加快
B.图②可表示![]() 时,用
时,用![]() 的
的![]() 溶液滴定20mL
溶液滴定20mL![]() NaOH溶液,溶液的pH随加入的酸的体积的变化情况
NaOH溶液,溶液的pH随加入的酸的体积的变化情况
C.若图③表示向含![]() 、
、![]() 、
、![]() 、
、![]() 的溶液中滴加NaOH溶液时,沉淀量随NaOH溶液加入量的变化情况,则使用的NaOH溶液的浓度为
的溶液中滴加NaOH溶液时,沉淀量随NaOH溶液加入量的变化情况,则使用的NaOH溶液的浓度为![]()
D.若图④表示向含![]() 、
、![]() 、
、![]() 、
、![]() 的溶液中滴加NaOH溶液时,沉淀量随NaOH溶液加入量的变化情况,则
的溶液中滴加NaOH溶液时,沉淀量随NaOH溶液加入量的变化情况,则![]() :
:![]()
![]() :
:![]() :3:2
:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均釆用虚线表示。
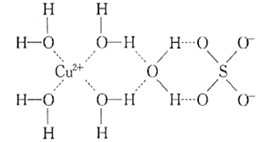
(1)写出与Cu在同一周期且未成对电子数最多的基态原子的电子排布式:______ ,S原子的价层电子排布图______________。
(2)写出胆矾晶体中水合铜离子的结构简式______________(必须将配位键表示出来)。
(3)向胆矾溶液中滴加氨水至过量,最终得到深蓝色的透明溶液,再加入乙醇后析出深蓝色晶体,写出生成深蓝色透明溶液的离子方程式__________。比较NH3和[Cu(NH3)4]2+中H-N-H 中键角的大小:NH3______[Cu(NH3)4]2+(填“>” “<” 或“=”)。
(4)已知H2O2的结构如图:
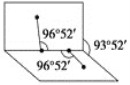
H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′,估计它难溶于CS2,简要说明原因__________________________。
(5)Co3+形成的化合物[Co(NH3)5N3]SO4中Co的配位数为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com