
【题目】通过实验探究发现化学反应中的某种规律,再寻求理论上的科学合理解释,是化学工作者的重要研究方法。
I.在体积可变的密闭容器中投入1 mol CO和2molH2,不同条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。

(1)M点H2的转化率为___________;反应速率N点v正(CO)___________M点ν逆(CO)(填“>”“<”或“=”)
(2)若M点对应混合气体的体积为1L,则506K时,该反应平衡常数K=___________(保留三位小数)。图表示平衡常数的对数(lgK)与温度的关系,B、C点中能正确表示该反应的lgK与T的关系的点为___________。

(3)在2L恒容密闭容器中充入 a mol H2、2 mol CO和7.4 mol CH3OH(g),在506K下进行上述反应。为了使该反应逆向进行,a的取值范围为___________。
Ⅱ.砷及其化合物有着广泛的用途。砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。已知H3AsO4的pKa1、pKa2、pKa3依次为2.25、6.77、11.40(已知:pKa=-lgKa)。
回答下列问题:
(4)NaH2AsO4溶液呈___________(填酸性”、“中性”或“碱性”),试通过计算说明___________。
(5)某小组同学欲探究可逆反应AsO33-+I2+2OH-![]() AsO43-+2I-+H2O,设计如图所示装置。加入试剂并连接裝置,电流由C2流入C1。当电流变为零时,向装置左边烧杯中逐滴加入一定量2 mol/L HCl,发现又产生电流,实验中电流与时间的关系如图所示。
AsO43-+2I-+H2O,设计如图所示装置。加入试剂并连接裝置,电流由C2流入C1。当电流变为零时,向装置左边烧杯中逐滴加入一定量2 mol/L HCl,发现又产生电流,实验中电流与时间的关系如图所示。

写出图4中c点对应的正极反应式___________,能判断该反应达到平衡状态的是___________。
a.2v(I-)正=v(AsO33-)逆 b.溶液pH不再变化
c.电流表示数变为零 d.右边烧杯中c(K+)不变
【答案】25% < 0.148 B a<10 酸性 Kh3=![]() =
=![]() =10-11.75<10-6.77即Ka2>Kh3,溶液呈酸 AsO43-+2e-+2H+=AsO32-+H2O bc
=10-11.75<10-6.77即Ka2>Kh3,溶液呈酸 AsO43-+2e-+2H+=AsO32-+H2O bc
【解析】
(1)根据图像可知,M点时,生成的甲醇为0.25mol,则反应的H2为0.5mol,H2的转化率=0.5mol/2mol×100%=25%;其他条件相同时,压强越大,反应速率越快,反应速率:N点v正(CO)<M点ν逆(CO)。
(2)平衡时消耗氢气是0.5mol,剩余CO和氢气分别是0.75mol、1.5mol,溶剂为1L,所以506K时该反应的平衡常数K=0.25/(0.75×1.52)=0.148;正反应放热,升高温度平衡向逆反应方向进行,平衡常数减小,lgK减小,所以能正确表示该反应的lgK与温度(T)的关系点为B。
(3)起始浓度c(CO)=1mol/L,c(H2)=0.5amol/L,c(CH3OH)=3.7mol/L,浓度熵Qc=![]() ,为了是该反应逆向进行,要求Qc>K,即
,为了是该反应逆向进行,要求Qc>K,即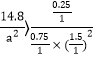 ,a的范围为a<10。
,a的范围为a<10。
(4)NaH2AsO4溶液呈酸性,Kh3=![]() =
=![]() =10-11.75<10-6.77即Ka2>Kh3,溶液呈酸性。
=10-11.75<10-6.77即Ka2>Kh3,溶液呈酸性。
(5)图4中c点酸性条件下对应图3装置的正极AsO43-得电子产生AsO33-,电极反应式为AsO43-+2e-+2H+=AsO32-+H2O。a.根据速率关系,v(I-)正=2v(AsO33-)逆,则等式始终成立,反应不一定处于平衡状态;b.溶液的pH不再变化,则氢氧根离子浓度也保持不变,反应处于平衡状态;c.电流表示数变为零则氧化还原反应中电子转移不再增减,反应物的浓度保持不变,反应处于平衡状态;d.右边烧中K+没有参与反应,则c(K+)始终不变,反应不一定处于平衡状态,答案选bc。
(1)根据图像可知,M点时,生成的甲醇为0.25mol,则反应的H2为0.5mol,H2的转化率=0.5mol/2mol×100%=25%;其他条件相同时,压强越大,反应速率越快,反应速率:N点v正(CO)<M点ν逆(CO)。本小题答案为:25% ;< 。
(2)平衡时消耗氢气是0.5mol,剩余CO和氢气分别是0.75mol、1.5mol,溶剂为1L,所以506K时该反应的平衡常数K=0.25/(0.75×1.52)=0.148;正反应放热,升高温度平衡向逆反应方向进行,平衡常数减小,lgK减小,所以能正确表示该反应的lgK与温度(T)的关系点为B。本小题答案为:0.148;B。
(3)起始浓度c(CO)=1mol/L,c(H2)=0.5amol/L,c(CH3OH)=3.7mol/L,浓度熵Qc=![]() ,为了是该反应逆向进行,要求Qc>K,即
,为了是该反应逆向进行,要求Qc>K,即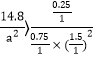 ,a的范围为a<10。本小题答案为:a<10。
,a的范围为a<10。本小题答案为:a<10。
(4)NaH2AsO4溶液呈酸性,Kh3=![]() =
=![]() =10-11.75<10-6.77即Ka2>Kh3,溶液呈酸性。本小题答案为:酸性;Kh3=
=10-11.75<10-6.77即Ka2>Kh3,溶液呈酸性。本小题答案为:酸性;Kh3=![]() =
=![]() =10-11.75<10-6.77即Ka2>Kh3,溶液呈酸性。
=10-11.75<10-6.77即Ka2>Kh3,溶液呈酸性。
(5)图4中c点酸性条件下对应图3装置的正极AsO43-得电子产生AsO33-,电极反应式为AsO43-+2e-+2H+=AsO32-+H2O。a.根据速率关系,v(I-)正=2v(AsO33-)逆,则等式始终成立,反应不一定处于平衡状态;b.溶液的pH不再变化,则氢氧根离子浓度也保持不变,反应处于平衡状态;c.电流表示数变为零则氧化还原反应中电子转移不再增减,反应物的浓度保持不变,反应处于平衡状态;d.右边烧中K+没有参与反应,则c(K+)始终不变,反应不一定处于平衡状态,答案选bc。本小题答案为:AsO43-+2e-+2H+=AsO32-+H2O;bc。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】肉桂酸为微有桂皮香气的无色针状晶体,能抑制黑色酪氨酸酶的形成,是高级防晒霜中不可少的成分之一。实验室制取肉桂酸的原理如下:

实验步骤:
步骤1 在图1所示装置(夹持与加热仪器未画出,下同)的三颈烧瓶内加入K2CO3、苯甲醛(油状物)和乙酸酐,混合均匀后,在170 ℃~180 ℃加热反应1 h,冷却。
 图1
图1  图2
图2  图3
图3
步骤2 向三颈烧瓶内分批加入20 mL水和Na2CO3固体,调节溶液pH约为8。
步骤3 在三颈烧瓶中加入活性炭,用图2所示水蒸气蒸馏装置蒸馏除去未反应的苯甲醛。
步骤4 将三颈烧瓶内反应混合物趁热过滤,滤液冷却至室温,用浓盐酸酸化至pH=3,析出大量晶体,抽滤。并用少量冷水洗涤晶体。
步骤5 将晶体在图3所示热水浴上加热干燥。
(1)图1中仪器A的作用是____________。
(2)步骤2中Na2CO3需分批加入的原因是_________________________________________________。
(3)水蒸气蒸馏时,判断蒸馏结束的方法是________。
(4)步骤4中,“趁热过滤”的目的是_____________。
(5)抽滤时所需主要仪器有____、安全瓶及抽气泵等。
(6)与使用烘箱烘干相比,热水浴干燥的优点是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)铁屑加入硝酸银溶液中反应的离子方程式为______。
(2)醋酸(CH3COOH)与烧碱溶液反应的离子方程式为______。
(3)NaHSO4是一种______(填“酸、碱、盐”),向NaHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性时,该反应的离子方程式为_____。
(4)实验室制备少量Fe(OH)3胶体的化学方程式为______。
(5)配平下列方程式:____SO32-+___IO3-+___H+=___SO42-+___I2+___H2O,______
(6)一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O,从而可知在RO3n-中,元素R的化合价是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应为:4M+nO2+2nH2O=4M(OH)n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是

A. 比较Mg、Al、Zn三种金属-空气电池,Mg-空气电池的理论比能量最高
B. 为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
C. 电池放电过程的正极反应式:O2+2H2O+4e-=4OH-
D. 多孔电极可提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸的电离方程式为CH3COOH(aq)![]() H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
A. 向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小
B. 向该溶液中加少量CH3COONa固体,平衡正向移动
C. 该温度下0.01mol/L醋酸溶液Ka<1.75×10-5
D. 升高温度,c(H+)增大,Ka变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将100 mL 1 mol·L-1的氨水与100 mL a mol·L-1盐酸等体积混合,忽略反应放热和体积变化,下列有关推论不正确的是
A. 若混合后溶液pH=7,则c(NH4+)=c(Cl-)
B. 若a=2,则c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C. 若a=0.5,则c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. 若混合后溶液满足c(H+)=c(OH-)+c(NH3·H2O),则可推出a=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、H2、C都是优质的能源物质,根据下列信息回答问题:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
④ 2CO(g)+O2(g)=2CO2(g) △H =-566.0 kJ·mol-1

(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量________(填“>”“<”或“=”)890.3kJ。
(2)已知H-H的键能436kJ/mol O=O的键能496kJ/mol H-O的键能463kJ/mol,根据上述数据(能否)______________计算②的反应热
(3)若1molCH4 气体完全燃烧生成CO2气体和水蒸气, 放出的热量______(填“大于”“等于”或“小于”)890. 3kJ。
(4)计算CO2(g)+4H2( g ) =CH4( g ) +2H2O( l )的焓变△H=__________。
(5)甲烷与CO2可用于合成水煤气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2,1gCH4完全反应可释放15.46kJ的热量,若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,
①体系放出的热量随着时间的变化如图所示,则CH4的转化率为________。

②相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为________(整数比)
(6)①石墨中C-C键键能________金刚石中C-C键键能。(填“大于” “小于”或“等于”)。
②写出石墨转化为金刚石的热化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂亚硫酰氯(Li/SOCl2)电池是实际应用电池系列中比能量最高的一种电池,剖视图如图所示,一种非水的LiAlCl4的SOCl2溶液为电解液。亚硫酸氯既是电解质,又是正极活性物质,其中碳电极区的电极反应式为2SOCl2+4e-=4Cl-+S+SO2↑,该电池工作时,下列说法错误的是( )

A. 锂电极区发生的电极反应:Li-e-=Li+
B. 放电时发生的总反应:4Li+2SOCl2=4LiCl+SO2↑+S
C. 锂电极上的电势比碳电极上的低
D. 若采用水溶液代替SOCl2溶液,电池总反应和效率均不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2012年伦敦奥运会火炬采用丙烷为燃料。丙烷热值较高,污染较小,是一种优良的燃料。试回答下列问题:

①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“-”。
②写出表示丙烷燃烧热的热化学方程式:___________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为________。
(2)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知:H2O(g)=H2O(l) ΔH1=-Q1 kJ/mol C2H5OH(g)=C2H5OH(l) ΔH=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-Q3 kJ/mol
若使46 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为________kJ。
②碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应: C(s)+![]() O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com