
����Ŀ������ij�¶���,��2 L������3�����ʼ���з�Ӧ,X��Y��Z�����ʵ�����ʱ��ı仯������ͼ����Ӧ��t1 minʱ����ƽ��,��ͼ��ʾ:

��1���÷�Ӧ�Ļ�ѧ����ʽ�� ��
��2������������Ӧ��X��Y��Z�ֱ�ΪNH3��H2��N2,����֪1 mol �����ֽ�ɵ���������Ҫ����46 kJ������,����t1 minʱ,�÷�Ӧ���յ�����Ϊ ;�ڴ�t1 minʱ����,��H2��ʾ��Ӧ��ƽ������v��H2��Ϊ ��
�����������ƺ͵������������Һ�ﷴӦ�Ļ�ѧ����ʽ�ǣ�
Na2SO3+KIO3+H2SO4 = Na2SO4+K2SO4+I2+H2O��
�÷�Ӧ���̺������ϸ��ӣ�һ����Ϊ��Ϊ���¼�����
IO3-+SO32-��IO2-+SO42-��������IO2-+ SO32-��IO-+SO42-������
��5I-+6H++ IO3-��3I2+3H2O��������I2+ SO32-+ H2O��2I-+ SO42-+2H2������
��1���������������Ʋ⣬�˷�Ӧ���ܵķ�Ӧ������ ����Ӧ������
��2����Ԥ�ȼ��������Һ�������������� ����������ʱ���Ż�ʹ����̸�������������
���𰸡�������1��2X![]() 3Y+Z ������=�����÷�����2����36��8 kJ
3Y+Z ������=�����÷�����2����36��8 kJ ![]() mol/��L��min��
mol/��L��min��
������1���� ��2��SO32-
��������
���������I����1������ͼ�����Կ�������Ӧ��X�����ʵ�����С��Y��Z�����ʵ������࣬��XΪ��Ӧ�Y��ZΪ������ҡ�n��X������n��Y������n��Z��=0��8mol��1��2mol��0��4mol��2��3��1���������仯��֮������Ӧ�Ļ�ѧ������֮�ȿ�֪��Ӧ�Ļ�ѧ����ʽΪ��2X![]() 3Y+Z��
3Y+Z��
��2����t1minʱ������NH3�����ʵ���Ϊ0��8mol�������յ�����Ϊ0��8mol��46kJ/mol��36��8kJ��H2�ķ�Ӧ����ΪY�����ڴ�t1minʱ���ڣ���H2��ʾ��Ӧ��ƽ������v��H2����1��2mol����2L��t1min����![]() ��
��
II����1������Ӧ������Ӧ���ʣ���˷�Ӧ���ܵķ�Ӧ�����ɢٲ���Ӧ��������ѡ�٣�
��2���ɷ�Ӧ�ܿ�֪��SO32-�Ļ�ԭ�Դ���I-���ɱ�I2������������������SO32-���Ż�����I2���Ż�����Һ���������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���һ�ֽϳ�ʹ�õĻ��ʣ����ڳ������ֽ⡣ij��ѧ��ȤС���̼淋ijɷִ������ʣ�ʱ��������̽����
������ʵ�顿������Һ�е�����������
ȡ������������Թ��У��������ᣬ�����ɵ�����ͨ�����ʯ��ˮ�У��а�ɫ�������ɣ�����ȡ����̼立����Թ��У�����ŨNaOH��Һ�����ȣ���ʪ��ĺ�ɫʯ����ֽ�������ɵ����壬ʯ����ֽ����ɫ��
��1������ʵ�������Ʋ�̼��������������ӿ�����_______��_______��
��2������ʵ������̼�������NaOH��Һ���ȷ�Ӧ�����ӷ���ʽ������__________ __________��
���������顿�ⶨ̼���CԪ�غ�NԪ�������ȣ�����ȤС��ȷ��ȡag̼泥�����ʹ֮�ֽ⣬���Ѳ���ͨ���ʯ���У���ͼ��ʾ��

��3��̼粒���Ӧ����________�н��м��ȣ�
A���Թ� B�������� C����ƿ D������
��4���Ӱ�ȫ�ĽǶȿ��ǣ�β��������װ�ÿ���ѡ��________��

��5�������պ�û�й�����࣬����U�ι���ʵ��ǰ���������Ϊbg���ɴ˲��NԪ�ص�������_____g��
��6��Ϊ�˲ⶨ̼���̼Ԫ�ص�������������Ƶ�ʵ�鷽���ǽ�ag̼���ȫ�ܽ���ˮ���������BaCl2��Ȼ��ⶨ���ɳ����������������۸÷����Ƿ������________(��������������������)��������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к��ḻ�ĵ�Ԫ�����Ӻ����з������ɰ����²��������
�ٵμ�ϡ�����ữ��������H2O2����������Ϊ3%����
�ڽ��������ճɻҺ��ˮ���� ��
�ۼ�CCl4�� ��
���÷�Һ©����Һ��
����С����ˡ�
�����IJ���˳������ ��
A���٢ڢۢܢ� B���ڢݢ٢ۢ� C���٢ۢݢڢ� D���ڢ٢ۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ȼ�����һ��ʳ�����ϣ���ṹ��ʽ��ͼ�����ڸ��л������������ȷ����

��1mol����������3mol H2��
�����ܷ���������Ӧ��
������ʽΪC12H20O2��
������ͬ���칹���п����з��ࣻ
��1 mol���л���ˮ��ʱֻ������1 mol NaOH
A���ڢۢ� B���٢ܢ� C���٢ڢ� D���ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ��е���A��Ԫ�صĵ��ʼ��仯�������;�㷺��
��1������Ԫ��ͬ��Ķ�����Ԫ�ص�ԭ�ӽṹʾ��ͼΪ
��2������Ϊ�ȡ��塢��Ԫ�طǽ����Եݱ���ɵ��ж������ǣ� ��
a��HCl��HBr��HIˮ��Һ������
b��Cl2��Br2��I2���۵�
c��HCl��HBr��HI�����ȶ���
d��Cl2��Br2��I2��������
��3����ҵ�ϣ�ͨ������ת�����Ƶ�KCl03���壺

�ڢ���Ӧ����������KCIO3���������������������ԭ����
��4��һ�������£���ˮ��Һ��1mol Cl-��ClOx-��x=1��2��3��4����������kJ����Դ�С��ͼ��ʾ��

��D��_________�������ӷ��ţ���
��B��A+c��Ӧ���Ȼ�ѧ����ʽΪ___________�������ӷ��ű�ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X��һ���л��ϳ��м��壬Z�dz����ĸ߷��ӻ����ij�о�С���������·�ߺϳ�X��Z��

��֪����������A�Ľṹ����2����
��RCOOR��+R��CH2COOR�� ![]()

��ش�
��1��д��������E�Ľṹ��ʽ__________��F�й����ŵ�������_________��
��2��Y��Z�Ļ�ѧ����ʽ��____________��
��3��G��X�Ļ�ѧ����ʽ��__________����Ӧ������___________��
��4����C�л���B�����û�ѧ��������B�Ĵ��ڣ�Ҫ��д������������ͽ��ۣ�_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D���ֶ�����Ԫ�أ����ǵ�ԭ��������A��D����������֪A��Bԭ������ͬ�ĵ��Ӳ�������A��L���������K���������������Cȼ��ʱ���ֻ�ɫ���棬C�ĵ����ڵ�ȼ��������B�ĵ��ʳ�ַ�Ӧ�����Եõ�����ɫ��̬�����D��M�������ΪK���������3�����Ը������������ش�
��1��д��Ԫ�����ƣ�A D ��
��2������D��ԭ�ӽṹʾ��ͼ ��
��3���õ���ʽ��ʾ������C2D���γɹ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȸʯ��һ�ֺ�ͭ��ʯ����ͭ��̬ΪCuCO3��Cu(OH)2��CuSiO3��2H2O��ͬʱ����SiO2��FeCO3��Fe2O3��Al2O3�����ʡ�����Ϊԭ����ȡ����ͭ�Ĺ���������ͼ��

��1�� ��ɲ������ϡ������CuSiO3��2H2O��Ӧ�Ļ�ѧ����ʽ:
CuSiO3��2H2O+H2SO4=CuSO4 +_______+H2O��˫��ˮ��������____ ��
��2�� ����ڵ�����ҺpH,����ѡ�õ��Լ���______
A�� CuO B��Fe2O3 C��Al2O3 D Cu(OH)2
��3�� �й��������↑ʼ��������ȫ������pH���±���
�������� | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
��ʼ������pH | 3.3 | 1.5 | 6.5 | 4.2 |
������ȫ��pH | 5.2 | 3.7 | 9.7 | 6.7 |
�������У�����pH=4ʱ����������B�ijɷֵĻ�ѧʽΪ �� ��
��4�� ����ҺBͨ�� �� �����˵Ȳ����ɵõ�����ͭ���塣
��5�� �ⶨ����ͭ����ᾧˮ�ĺ���ʱ��Ӧ�������______������������ʧˮ��,���ڿ�������ȴ�������ⶨ���__ ___(�ƫ�ߡ�����ƫ�͡����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ƾ���(Na2S2O3��5H2O��ʽ��248) ������������ҵ�Ķ�Ӱ������������ˮ�����ܽ�����¶����߶����������������Ҵ�������ʱ�ֽ⣬ʵ����ģ�ҵ�Ʊ���������ƾ���ͨ�������ַ�����(���ʲ�����ˮ�����ھƾ�)
I �������Ʒ���Na2SO3��S��5H2O=Na2S2O3��5H2O������ʵ������������

��1��������Ҵ���ʪ��Ŀ���� ��
��2��ϴ�Ӵֲ�Ʒ������ϴ�Ӽ�����ʵ��� ��
A.��ˮ B.��ˮ C.�Ҵ� D.�Ҵ�-ˮ�����Һ
��3�����ôֲ�Ʒһ��ͨ�� �����ᴿ��
II���2Na2S��Na2CO3��4SO2=3Na2S2O3��CO2����Ҫʵ��װ��������
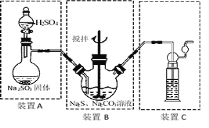
��4��װ��C�пɷ��� ��
A.BaCl2��Һ B.ŨH2SO4 C.����KMnO4��Һ D.NaOH��Һ
��5��Ϊ�ⶨ�ֲ�Ʒ��Na2S2O35H2O�Ĵ��ȡ�ij��ȤС���ȡ5.0 g�ֲ�Ʒ���250mL��Һ�����ü�ӵ������궨����Һ��Ũ�ȣ�����ƿ�м���25mL 0.01mol/L KIO3��Һ�������������KI���ữ���������з�Ӧ��5I����IO3����6H+=3I2��3H2O���ټ��뼸�ε�����Һ������������Na2S2O3��Һ�ζ���������Ӧ��I2��2S2O32��=2I����S4O62��������ɫ��ȥ�Ұ���Ӳ���ɫʱ����ζ��յ㡣ʵ���������±���
����� | 1 | 2 | 3 |
����Na2S2O3��Һ(mL) | 19.98 | 21.18 | 20.02 |
�ò�Ʒ�Ĵ����� ��
��6����������Ʋ������¶ȡ�pHӰ������ͼ��

����˵������ȷ���� ��
A.����Na2S2O3һ���Ƿ��ȷ�Ӧ
B. �Ʊ�Ӧ��ȡ�ϵ��¶�
C.Na2S2O3һ���ܺ�0.1mol��L-1�����ᷢ����Ӧ
D.����pH���¶ȣ��������Na2S2O3�IJ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com