
| A. | 使湿润淀粉-KI试纸变蓝色的气体必为氯气 | |
| B. | 氟气与熔融状态下氯化钠反应可产生氯气 | |
| C. | 易见光分解的AgNO3晶体,应存放于棕色细口试剂瓶中 | |
| D. | 溴水应存放在胶头滴瓶(棕色)中 |
分析 A.具有氧化性的气体可氧化KI;
B.氧化性氟气大于氯气;
C.晶体应在广口瓶中;
D.胶头滴瓶中不能长时间存放试剂.
解答 解:A.具有氧化性的气体可氧化KI,则使湿润淀粉-KI试纸变蓝色的气体可能为氯气、臭氧等,故A错误;
B.氧化性氟气大于氯气,则氟气与熔融状态下氯化钠反应可产生氯气,故B正确;
C.晶体应在广口瓶中,则易见光分解的AgNO3晶体,应存放于棕色广口试剂瓶中,故C错误;
D.胶头滴瓶中不能长时间存放试剂,则溴水应放在棕色细口瓶中,故D错误;
故选B.
点评 本题考查物质的性质,为高频考点,把握物质的性质及发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
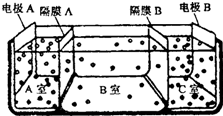
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
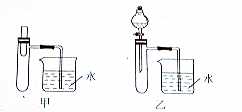
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O互为同素异形体 | |
| B. | O2与O3互为同位素 | |
| C. | CH3-CH2-OH与CH3-O-CH3互为分异构体 | |
| D. | H2O与D2O互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2-甲基-2-丁烯 | B. | 2-丁炔 | ||
| C. | 2-甲基-1,3-丁二烯 | D. | 1,3-丁二炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
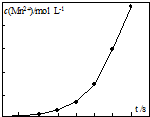 草酸钠滴定法测定高锰酸钾的质量分数步骤如下:
草酸钠滴定法测定高锰酸钾的质量分数步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com