
| A. | 少量白磷贮存于水中,切割时要在水下进行 | |
| B. | 液溴直接保存于磨口玻璃塞的细口棕色瓶中 | |
| C. | KOH溶液存放在磨口玻璃塞的广口瓶中 | |
| D. | 少量金属钠存放在无水乙醇中 |
分析 A.白磷熔点低,和水不反应;
B.液溴易挥发,需要用水封保存;
C.氢氧化钾溶液会与玻璃塞中的二氧化硅反应;
D.钠能够与乙醇发生反应.
解答 解:A.白磷熔点为40℃且和水不反应,其密度大于水,所以少量的白磷贮存在水中,切割时在水下进行,故A正确;
B.溴易挥发,需要水封保存,且应保存在磨口玻璃塞棕色细口试剂瓶中,故B错误;
C.氢氧化钾与玻璃中的二氧化硅反应生成具有黏性的硅酸钠,易导致玻璃塞打不开,应该使用橡胶塞,故C错误;
D.钠与乙醇发生反应,不能保存在乙醇中,可保存在煤油中,故D错误;
故选B.
点评 本题考查药品的保存,题目难度不大,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握相关物质的性质,注意相关基础知识的积累.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{10}{11}$ | B. | $\frac{7}{11}$ | C. | $\frac{6}{11}$ | D. | $\frac{4}{11}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S和NH3价电子总数均是8 | |
| B. | 次氯酸分子的结构式为:H-Cl-O | |
| C. | HS-和HCl均是含一个极性键的18电子粒子 | |
| D. | 1 mol D216O中含中子、质子、电子各10 NA(NA代表阿伏加德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ③ | C. | ②③ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
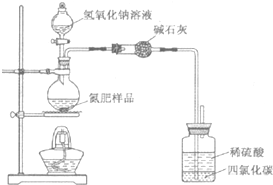 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:| 氢氧化钠溶液/mL | 40.00 | ||
| 样品质量/g | 7.750 | 15.50 | 23.25 |
| 氨气质量/g | 1.870 | 1.870 | 1.700 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=10的NaOH和CH3COONa溶液中,水的电离程度 | |
| B. | 25℃与80℃纯水的pH | |
| C. | 将pH=3的醋酸和盐酸分别稀释100倍后溶液的pH | |
| D. | 相同温度下,10mL0.1mol•L-1的醋酸与100mL0.01mol•L-1的醋酸中的H+物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫原子的原子结构示意图: | |
| B. | NH4Cl的电子式: | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 乙烯的最简式为CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓的强酸和稀的强碱溶液反应 | B. | 浓的弱酸和稀的强碱溶液反应 | ||
| C. | 等pH值的强酸和弱碱溶液反应 | D. | 生成一种强酸弱碱盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com