
����Ŀ��ijʵ��С�����ѧ�α��п����������ķ�Ӧ�������о����ܽ��������������H2�ķ�Ӧ����Zn+���� ��Na+ˮ ��ش��������⣺

��1��д���١��ڷ�Ӧ�����ӷ���ʽ
��__________________________________________��
��________________________________________________________
��2���ڵ�ȼH2֮ǰ�����Ƚ���_______________________________________��
��3��ʵ��С���ڵ�ȼ������װ���Ƶõ�H2ʱ����ʵ���óɹ�����ȴʧ���ˡ����Ƿ�����Ϊʧ�ܵ�ԭ����Na��H2O�ķ�Ӧ����̫�죬Na������̫�١����������������Ƶ�����������ʦ˵̫Σ�գ�����Ϊ����Σ�յ�ԭ��___________________________________________________________________
��4��ʵ��С������ơ�����ˮ���ܶȷֱ�Ϊ0.97g/mL��0.88g/mL��1.00g/mL�����ݴ˶�ʵ������˸Ľ����ڸĽ����ʵ����H2���������ʻ�_______________���Ľ����ʵ������Ϊ_________________________________________________________________________��
��5��2.3 g��Ͷ��20 mLˮ����ȫ��Ӧ�ų��������ڱ�״���µ������____________,������Һ�����ʵ���Ũ����______________________��(������Һ����ı仯)
���𰸡� Zn+2H+=Zn2++ H2�� 2Na+2H2O = 2Na++2OH-+H2�� ����H2�Ĵ��� ��������ˮ��Ӧ���ң��ų��������ȣ�����ʹ�Թ���H2��O2�Ļ������ȼ����ը ���� �ƴ��ڱ���ˮ�Ľ��紦������ˮ��Ӧ������H2ʹ�Ƹ�������ˮ�棬��Ӧֹͣ�����Ʊ����H2�ݳ������ֻ���ˮ�㣬��˷������Ƽ�Ъ��ˮ��Ӧ 1.12L 5mol/L
��������(1)п�����ᷴӦ�����Ȼ�п�����������ӷ���ʽΪZn+2H+=Zn2++ H2��������ˮ��Ӧ�����������������������ӷ���ʽΪ��2Na+2H2O�T2Na++2OH-+H2�����ʴ�Ϊ��Zn+2H+=Zn2++ H2����2Na+2H2O�T2Na++2OH-+H2����
(2)�ڵ�ȼH2֮ǰ�����Ƚ��м���H2�Ĵ��ȣ����ⷢ����ը���ʴ�Ϊ������H2�Ĵ��ȣ�
(3)��������ˮ��Ӧ���ң��ų��������ȣ�����ʹ�Թ���H2��O2�Ļ������ȼ����ը���ʴ�Ϊ����������ˮ��Ӧ���ң��ų��������ȣ�����ʹ�Թ���H2��O2�Ļ������ȼ����ը��
(4)�ƴ��ڱ���ˮ�Ľ��紦������ˮ��Ӧ������H2ʹ�Ƹ�������ˮ�棬��Ӧֹͣ�����Ʊ����H2�ݳ������ֻ���ˮ�㣬��˷�������С��Na��H2O�ķ�Ӧ���ʣ��ʴ�Ϊ���������ƴ��ڱ���ˮ�Ľ��紦������ˮ��Ӧ������H2ʹ�Ƹ���������ˮ�棬��Ӧֹͣ�����Ʊ����H2�ݳ������ֻ���ˮ�㣬��˷������Ƽ�Ъ��ˮ��Ӧ��
(5)2.3g�����Ƶ����ʵ���Ϊ![]() =0.1mol�������ɵ��������Ƶ����ʵ���Ϊy�������������ʵ���Ϊz����
=0.1mol�������ɵ��������Ƶ����ʵ���Ϊy�������������ʵ���Ϊz����
2Na+2H2O=2NaOH+H2��
2 2 1
0.1mol y z
����2��2=0.1mol��y�����y=0.1mol��2��1=0.1mol��z��z=0.05mol������������״�������=0.05mol��22.4L/mol=1.12L������������������Һ�����ʵ���Ũ��Ϊ![]() =5mol/L���ʴ�Ϊ��1.12L��5mol/L��
=5mol/L���ʴ�Ϊ��1.12L��5mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��һ�ܱ���������Ħ�����ɻ�����������a��b�ֳɼס������ң���״���£��������г���0.6mol HCl�������г���NH3��H2�Ļ�����壬��ֹʱ����λ������ͼ����֪�ס������������������֮��Ϊ10.9g��

��1����������������ʵ���Ϊ__________mol��
��2��������NH3��H2�����ʵ���֮��Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���з�Ӧ�����ӷ���ʽ��
A. �ù���ʯ�������չ�ҵβ���е�SO2: Ca2++2OH-+SO2��CaSO3 ��+ H2O
B. ������KMnO4��Һ��H2O2��Ӧ��֤��H2O2���л�ԭ�ԣ�2MnO4��+6H++5H2O2��2Mn2++5O2 ��+8H2O
C. ��ͭ���缫���NaCl��Һ:2C1��+2H2O![]() H2��+Cl2��+2OH-
H2��+Cl2��+2OH-
D. �� Fe2O3���뵽 HI ��Һ�У�Fe2O3+ 6H+��2Fe3+ +3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������м������ɲ����գ�����400�棩�������ʵ���Һ�����Եõ������ʵĹ�����ǣ� ��
A.�Ȼ���B.̼������C.������D.�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯��˷����ۼ�����
A. �ɱ����ȱ�ɶ�����̼���� B. ���ʯ�ۻ� C. ��������ˮ D. ʳ������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ��ij��Һ�У���ˮ�������c(H+)=1��10-12mol��L-1�������Һ��pH�����ǣ� ��
A.12B.7C.6D.2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��AgOH�ܲ��ȶ����ֽ�����Ag2O����ɫ������ҺX�п��ܺ����������ӣ�Ag+��NH4+��Fe3+��SO42-��SO32-��Cl-�еļ������ӡ�Ϊ��ȷ������ɣ�ijͬѧ����������ʵ�飺
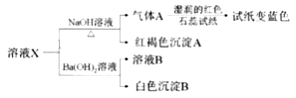
����˵������ȷ���ǣ� ��
A. ��ҺX��NaOH��Ӧ���ɺ��ɫ����A�����Ʋ����Һ�в�����SO32-
B. ��ҺX��һ������Ag+
C. ��ҺX��һ������NH4+��Fe3+��SO42-
D. ȡ������ҺB������AgNO3��Һ�����г�������������Cl-
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com